Introducción
La American Burn Association describe que las quemaduras son responsables de 40.000 ingresos hospitalarios al año, un tercio de ellos son niños (1). Los menores de 5 años presentan con mayor frecuencia quemaduras por escaldaduras, aun en tiempos de pandemia por COVID 19, vivir en áreas de ingreso bajos y hacinamiento son un factor de riesgo para presentar quemaduras (2–4).
El tipo de quemadura va a depender de que la produce y se clasificará según el nivel de afectación de la piel, según el tipo existe la lesión térmica o por fuego la cual es la más frecuente en mayores de 5 años, la lesión por escaldadura que se produce por contacto con líquidos calientes, la lesión por contacto se da producto del contacto con materiales sólidos fríos o calientes, las lesiones química: secundario a contacto con sustancias químicas nocivas, quemaduras eléctricas las cuales son infrecuentes y se dan por transmisión de corriente eléctrica a través de los tejidos, también existen lesiones por explosión que son lesiones térmicas con lesiones traumáticas concomitantes.
Por otra parte, se tiene la clasificación según la profundidad de la quemadura como se muestra en la figura 1 (5–7).
Figura 1. Adaptado de: Josefina María Cabanela López, Jonatan Miguel Carrera, Martina López Peón, Quemaduras, FISTERRA, Elsevier 2018.

Aunque en la práctica clínica existen varias clasificaciones como la mencionada anteriormente, se recomienda tener presente por su valor clínico la establecida por Benaim, quien las clasifica según la profundidad en tres tipos diferentes, de acuerdo con la estructura histológica comprometida, es decir: Quemadura tipo A o superficial, quemadura tipo AB o intermedia y quemadura tipo B o profunda.
Resultados y discusión
Fisiopatología
La relación de la respuesta fisiológica a la quemadura depende de la extensión, a mayor extensión se da mayor mortalidad relacionado con la respuesta fisiológica y con complicaciones posteriores. Para adultos hasta los 65 años el límite de esta respuesta fisiológica es del 20% de superficie corporal total (SCT), mientras que en población pediátrica es del 30% de la SCT (8). Pero Kraft y colaboradores (9) establecen que un tamaño de 60% de la SCT es el umbral crucial para la morbimortalidad por quemadura, diferente al estudio anterior que referenciaba que el compromiso alrededor de 40% de la SCT significaba una mayor morbimortalidad en niños realizado por Ryan y col. (10). Esto puede ser secundario a la mejora del manejo integral multidisciplinarios de hoy (10 -11).
Las lesiones por inhalación son un término utilizado para referirse al daño del tracto respiratorio o parénquima pulmonar por lesión térmica directa o irritantes químicos que causan daño tisular o efectos sistémicos por las toxinas inhaladas, este tipo de lesiones requieren diagnóstico temprano dada su asociación con alta mortalidad y su gravedad depende de la composición de los agentes inhalados, la intensidad a la exposición y las comorbilidades preexistente en el paciente, además en la edad pediátrica los órganos y sistema se encuentran en etapa de desarrollo y tanto su anatomía como fisiología son inmaduras, por esto los pacientes con estas lesiones se encuentran en condición crítica con alto riesgo de síndrome de dificultad respiratoria aguda (12,13). El hipermetabolismo es un efecto que altera la tasa metabólica, secundario en el paciente quemado a la lesión térmica, retrasa la cicatrización de heridas, pérdida de masa corporal magra, produce regulación positiva de catecolaminas, el cortisol y el glucagón, con aumento en el consumo de oxígeno, gasto energético, proteólisis, lipólisis y glucogenólisis e inmunosupresión (14).
La piel es la barrera de transferencia de energía a tejidos más profundos, cuando se produce una lesión por quemadura esta área superficial se divide en tres zonas, de coagulación, zona de estasis y zona de hiperemia (figura 2). Un área necrótica denominada zona de coagulación, este daño es irreversible y el área alrededor tiene un grado moderado de lesión la cual se denomina zona de estasis, esta puede llegar a ser zona de necrosis por coagulación y la última zona la hiperemia, se caracteriza por vasodilatación secundaria a la inflamación que rodea la quemadura (5).
Figura 2. Adaptado de: Jeschke MG, Herndon DN. Capítulo 19 - Quemaduras [Internet]. 20th Editi. Sabiston. Tratado de cirugía. Elsevier España-2020. 505–531 p. Available from: http://dx.doi.org/10.1016/B978-84-9113-132-8/00019-6

En los estados de quemaduras severas de gran extensión se ha encontrado afectación sistémica con manifestaciones como; la resistencia a la insulina, alteración del metabolismo de los lípidos con aumento de los triglicéridos, esto se explica por aumento de la tasa metabólica en quemaduras de gran extensión. También se relaciona con el catabolismo masivo de proteínas y afectación en la función y estructura de las proteínas hepáticas. En este estado hipermetabólico hay una respuesta por mediadores inflamatorios como, el factor estimulante de colonias de granulocitos, IL-8 e IL-10, produciendo estrés oxidativo y alteración hormonal de la termorregulación hipotalámica y la sensibilidad a la insulina (9).
En las lesiones por inhalación, los productos irritantes se depositan en las vías respiratorias, combinándose las secreciones acuosas de la mucosa con estos irritantes, produciendo una respuesta inicial por lesión directa del epitelio respiratorio y también por lesión térmica directa, esta respuesta incluye hiperemia, edema, alteración del aclaramiento ciliar y broncoconstricción, provocadas por el acumulo de células inflamatoria y el inicio de la cascada inflamatoria que exacerba y mantiene el daño tisular. El edema es el resultado de un aumento del flujo de líquido transvascular en los lechos vasculares, además de la activación del complemento que produce activación de histamina provocando la formación de xantina oxidasa que contribuye a la formación de ácido úrico por descomposición de las purinas, liberando especies reactivas de oxígeno y con el óxido nítrico forman especies reactivas de nitrógeno que aumentan el edema de la zona quemada y la presión microvascular y su permeabilidad. También por liberación de especies reactivas de oxígeno y nitrógeno se daña el ADN, activando el factor nuclear y por la hipoxia se da una mayor vasoconstricción pulmonar. La liberación de las especies reactivas de oxígeno y nitrógeno causan perdida de esta vasoconstricción llevando a mayor alteración ventilación/perfusión y como consecuencia disminución de la saturación de oxígeno. La respuesta inflamatoria de algunas células polimorfonucleares a nivel pulmonar pueden liberarse a la circulación sistémica y ser transportadas a otros órganos, promoviendo el daño a nivel multiorgánico (12,15).
El edema masivo de la orofaringe por alteración en la ecuación de Starling, se da por aumento de la presión hidrostática microvascular y una disminución de la presión hidrostática intersticial con ampliación de la presión oncótica intersticial, por lo cual el aumento de solución cristaloide en el manejo disminuye la presión oncótica plasmática aunque también aumenta el coeficiente de filtración por esto, se ha sugerido también la reanimación con líquidos como los coloides, con el fin de prevenir parte de este edema y reducir el volumen de líquidos necesarios para la reanimación (15).
En los estados hipermetabólicos existen dos respuestas: la respuesta inicial a las quemaduras esta se da en los primeros tres días después de la quemadura, dándose una disminución en la perfusión tisular y una disminución temporal en la tasa metabólica posterior; y la segunda fase se caracteriza por aumento del flujo hipermetabólico, con aumento de la perfusión de los tejidos superficiales, del estrés adrenérgico, de aumento en niveles de glucocorticoides y de citocinas inflamatorias (16).
Diagnostico
La evaluación inicial del paciente quemado se debe garantizar en el momento que sea retirado de la fuente causal de la quemadura y retirar objetos como ropa, joyas y descartar traumatismo. Se recomienda sobre verter agua fría sobre las quemaduras, aunque hay discrepancia en la literatura ya que algunos no recomiendan esta práctica con el fin de prevenir la hipotermia, lo que se debe realizar es cubrir al paciente con una sábana o manta limpia e irrigar agua solo si, la quemadura es por una sustancia química durante mínimo treinta minutos (14,17–19). En el examen físico si se encuentra taquipnea, estridor y ronquera son indicadores de un estrechamiento inminente de las vías respiratorias debido a una lesión por inhalación o edema, ante esta situación se debe solicitar gases arteriales y carboxihemoglobina, además se recomienda tomar una vía arterial para controlar la presión arterial siendo la vía femoral la más confiable, garantizar un catéter urinario para controlar el balance hidrico con el fin de evaluar la reanimación hídrica y sonda nasogástrica en pacientes con quemaduras graves por riesgo de íleo gástrico (14).
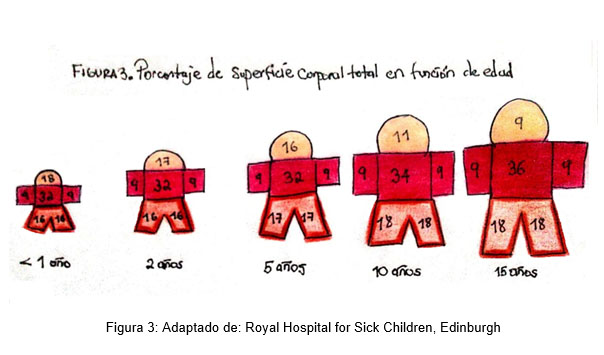
En los niños se debe realizar la medición de la superficie quemada con fórmula de Berkow (5). (figura 3). Mientras que en los adultos el volumen sanguíneo normal es de 70 ml / kg, a diferencia de los niños la perdida de líquidos es mayor por lo cual la regla de los nueves solo debe ser evaluada en adultos y adolescentes ya que en un niño la volemia es de 80 ml / kg de peso corporal y en los recién nacidos de 85 a 90 ml / kg (14).
Figura 3: Adaptado de: Royal Hospital for Sick Children, Edinburgh
Las lesiones por inhalación se deben sospechar cuando un paciente es expuesto a humo en un área cerrada, cuando tenga signos de quemadura facial, broncorrea, disfagia, esputo hollín, estridor, sibilantes o estertores y se confirma con broncoscopia, estos paciente usualmente cursan con inestabilidad hemodinámica, requiriendo aumento en el manejo de líquidos, inicialmente puede que no se evidencia la lesión parenquimatosa ni alteración en el intercambio gaseoso pero estas lesiones conllevaran a ello, también a neumonía, síndrome de dificultad respiratoria aguda y según su severidad conllevara a insuficiencia multiorgánica (12)
La tasa de infección es similar a otros grupos de pacientes inmunosuprimidos y si se presenta sepsis se puede aumentar la morbimortalidad, por lo cual las unidades deben tener programas de vigilancia de infección dado su riesgo por el efecto inmunosupresor de las quemaduras asociado a la pérdida de las barreras físicas y dispositivos invasivos. La anticipación del diagnóstico de infección y terapia adecuada cambia el pronóstico del paciente con quemadura (20).
Tratamiento
La calidad de la terapia recibida en estos pacientes juega un papel importante para la supervivencia, en este momento el tratamiento se centra en tres aspectos claves: en la atención primaria donde se estabilizará al paciente, reanimación, evaluación de quemaduras y necesidad de fasciotomía, descartar o definir quemaduras por inhalación, en segundo lugar se encuentra lo relacionado con el cuidado de las heridas, incluyendo el control de infecciones, mantenimiento de la función de los órgano y atenuar el hipermetabolismo (8,21). Y la tercera fase va dirigida a controlar el hipermetabolismo persistente y rehabilitación del paciente.
Otro punto importante es la modulación del dolor, se pueden utilizar opioides de acción corta y acción prolongada como metadona, ketamina, agentes de acción central como gabapentina, medicamentos antiinflamatorios no esteroideos, ansiolíticos y antidepresivos. No descuidar el uso de ansiolíticos y la analgesia particularmente durante los cambios de apósito para heridas, además del apoyo psicológico, ayudando al manejo de la ansiedad ya que se relaciona de manera directa con el dolor y técnicas de manejo no farmacológico para la distracción de los niños, como juegos tecnológicos (realidad virtual) masajes, hipnosis y acupuntura son algunas opciones (8,22,23-30).
Una parte esencial del manejo inicial es el manejo de los líquidos esta mantiene la perfusión orgánica en el momento del choque por quemadura con restauración del volumen intravascular, una de los métodos más utilizados es la fórmula de Parkland durante las primeras 24 horas (4 ml / kg de peso corporal y porcentaje del área de superficie corporal total quemado), aunque ha sido reportado que la estimaciones pueden no ser las correctas cuando se tratan de pacientes con quemaduras grandes y profundas, por lo cual existen otras opciones como Brooke modificada 1,5 ml / kg /% del área de superficie corporal total quemada de cristaloides y 0,5 ml / kg /% del área de SCT quemada de coloide (6,8,24,25).
Cuando se produce una reanimación insuficiente se presenta una disfunción orgánica múltiple y muerte; aunque una excesiva reanimación hídrica provoca un desplazamiento o fuga de líquidos que puede provocar complicaciones como edema pulmonar, derrame pleural y/o pericárdico, síndromes compartimentales, especialmente a nivel abdominal y conversión de quemaduras a heridas más profunda, lo anterior puede llevar a síndrome de dificultad respiratoria aguda, neumonía, infecciones del torrente sanguíneo, insuficiencia orgánica múltiple y muerte (26–28). Para evitar lo anterior se deben buscar indicadores de éxito durante el monitoreo del paciente, tradicionalmente, el principal es la producción de orina (0.5–1 ml / kg de peso corporal / h), presión arterial media mayor de 65mmHg, otras utilizadas son: el exceso de base, concentración de lactato y evaluar la perfusión aunque no siempre son precisos (8,24).
Otras medidas para evaluar la perfusión mediante la monitorización de parámetros hemodinámicos y volumétricos después de quemaduras graves son algunas técnicas invasivas como los catéteres de arteria pulmonar midiendo de forma directa la presión venosa central, presión de oclusión capilar pulmonar, el gasto cardiaco, el índice de resistencia vascular sistémica, la entrega y el consumo de oxígeno, pero se ha asociado con muchos más riesgos que beneficios en su uso. Otras medidas recomendadas, mínimamente invasiva son prometedoras, pero aún los marcadores fisiológicos clínicos son el estándar de oro, por lo cual estas técnicas se deben individualizar en su uso, algunas de estas son: catéteres con dilución térmica como; PICCO por sus siglas en inglés, (Pulsion Medical Systems, Munich, Germany) conservando monitorización hemodinámica avanzada sin necesidad de ser tan invasivo además de utilizar termo dilución transpulmonar (29–31).
Sobre el líquido utilizado en la reanimación, está la comparación de líquidos cristaloides con el uso de coloides en el uso diario del ejercicio médico, pero no hay un estudio que compare su efectividad de alguno sobre el otro en la reanimación hídrica por quemaduras, lo que se observa es que se utiliza cristaloide con mayor frecuencia y solo se administra coloides como método de rescate y como métodos para evitar desplazamiento de líquidos al tercer espacio vascular (28,32,33). Es necesario la monitorización de electrolitos dentro de los cuales esta principalmente el sodio dado que en menores de un año puede requerir mayor reposición por perdidas de este por orina, también el potasio, ya que su disminución debe ser manejada con fosfato de potasio oral dado que estos pacientes también presentan hipofosfatemia (14).
En el manejo de los pacientes con quemaduras por inhalación no hay intervenciones específicas, solo si las partículas inhaladas son cianuro y monóxido. Por lo tanto usualmente se maneja medidas de soporte como aumentar los líquidos en 50% de los requerimientos en la reanimación hídrica broncodilatadores como el salbutamol, heparina nebulizada, acetilcisteína nebulizada y adrenalina racémica; el uso de corticoide es contraindicado aunque ayuda en la disminución del edema de mucosa y reducción del broncoespasmo (12,34). Se recomienda manejar parámetros ventilatorios protectores, una ventilación mecánica volúmenes tidal bajo, FiO2 dinámico para mantener PaO2 80 y 100 mm Hg, extubar al paciente lo antes posible y considerar ventilación no invasiva, otro método para ventilación puede ser la ventilación de alta frecuencia. Estas opciones para garantizar una ventilación adecuada, si no se logra en quemaduras severa, se debe realizar una escarotomía del tórax para mejorar la ventilación. La necesidad de traqueostomía se ha indicado con mayor frecuencia en los pacientes quemados cuando necesitan ventilación mecánica prolongada (6,12,14,35). La oxigenación por membrana extracorpórea (ECMO) se ha considerado como apoyo en casos de pacientes con insuficiencia respiratoria refractaria al manejo convencional (36).
En el tratamiento del hipermetabolismo se han usado fármacos como hormona de crecimiento humana recombinante, aunque no es confiable en niños, esta aumenta la concentración de factor de crecimiento similar a la insulina 1, esto disminuye el gasto energético basal y el gasto cardíaco, esteroides anabólicos como testosterona y oxandrolona la cual aumenta la síntesis de proteínas musculares, reduce la pérdida de peso y promueve la cicatrización de heridas, además de antagonistas adrenérgicos como propanolol que es anticatabólico que aumenta la masa corporal magra y disminuye la hiperglicemia (8).
Otras medidas que se deben garantizar al paciente con quemadura es evitar la hipotermia y garantizar una nutrición adecuada, en algunos pacientes se recomienda que sea temprana hasta dos horas después de la quemadura para así preservar la integridad de la mucosa intestinal. Las quemaduras deben recibir una dieta alta en proteínas y calorías para suplementar la respuesta metabólica. Se pueden utilizar fórmulas como; de Curreri, Mayes o Galveston evaluando las necesidades calóricas en los pacientes quemados (6,14)
El uso de la nutrición parenteral se debe utilizar de manera prudente, es decir como segunda opción luego de que no se logra la nutrición enteral, es recomendada hipocalórica y rica en nitrógeno ya que puede reducir los déficits de energía y proteínas (37). El aporte de calorías es alrededor de 1,5 veces la tasa metabólica basal con requerimiento de 3-4 g/kg de proteínas al día. También es necesario administrar vitaminas, sobre todo las del grupo B, vitaminas C, A, y zinc (38). Se debe tener presente que la hospitalización en unidad de cuidado intensivo está asociada a mayor pérdida de masa grasa en extremidades superiores en niños con quemaduras. Por esto se deben incluir programas de movilización, incluyendo las extremidades superiores con el fin de contrarrestar dicho fenómeno y así disminuir complicaciones asociadas (39-40).
Conclusiones
La mayoría de las quemaduras en pacientes pediátricos con menores y/o leves, por lo cual pueden ser manejadas de forma ambulatoria; sin embargo, en quemaduras graves existen diferencias en la fisiología y psicología de los niños, requiriendo de experiencia en el cuidado de quemaduras pediátricas con recursos para la atención interdisciplinaria. Los efectos a largo plazo de las quemaduras se relacionan más allá de la lesión física y causar consecuencias psicológicas para el paciente y la familia. Por lo tanto, se recomienda un manejo integral mediante un equipo multidisciplinario formado por cirujanos de quemaduras, enfermeras, terapeutas, pediatras, psicólogos y psiquiatras que ofrecen curación en el entorno agudo y preparan al niño y familiares para recibir tratamiento y cuidados posteriores.
Referencias bibliografícas
- Association AB. National Burn Repository. 2015. http://ameriburn.org/research/burn-dataset/
- King ICC. Body image in paediatric burns: a review. Burns Trauma. 2018;6(12):2-6. DOI:10.1186/s41038-018-0114-3
- Brewster CT, Choong J, Thomas C et al. Steam inhalation and paediatric burns during the COVID-19 pandemic. Lancet (London, England).2020;395(10238):1690.https://doi.org/10.1016/S0140-6736(20)31144-2
- Alemayehu S, Afera B, Kidanu K, Belete T. Management Outcome of Burn Injury and Associated Factors among Hospitalized Children at Ayder Referral Hospital, Tigray, Ethiopia. Int J Pediatr. 2020;2020:9136256. doi: 10.1155/2020/9136256.
- Jeschke MG, Herndon DN. Capítulo 19 - Quemaduras [Internet]. 20th Editi. Sabiston. Tratado de cirugía [Internet]. Elsevier España; S.L.U.; 2020. 505–531 p. Available from: http://dx.doi.org/10.1016/B978-84-9113-132-8/00019-6
- Dupree PD, Makley AT, Kagan RJ. Burn and Inhalation Injuries. Fifth Edit. Pediatric Critical Care [Internet]. Elsevier Inc.; 2017.1582-1595. http://dx.doi.org/10.1016/B978-0-323-37839-0.00117-1
- Nymisha Chilukuri. Capitulo 2.Lesiones traumáticas. Quemaduras 22.a ed: Manual Harriet Lane de pediatría[Internet]. Elsevier España, S.L.U.; 2021.
- Jeschke MG, Herndon DN. Burns in children: standard and new treatments. Lancet.2014;383(9923):1168-78. doi: 10.1016/S0140-6736(13)61093-4.
- Grant GG, Brady KJS, Stoddard FJ, Meyer WJ, et al. Measuring the impact of burn injury on the parent-reported health outcomes of children 1-to-5 years: Item pool development for the Preschool1-5 Life Impact Burn Recovery Evaluation Profile CAT. J Burn Care Res. 2020;30;41(1):84-94. doi: 10.1093/jbcr/irz110
- Ryan CM, Schoenfeld DA, Thorpe WP, Sheridan RL, Cassem EH, Tompkins RG. Objective estimates of the probability of death from burn injuries. N Engl J Med. 1998;338(6):362–6. doi: 10.1056/NEJM199802053380604.
- Williams FN, Herndon DN, Hawkins HK, Lee JO, Cox RA, Kulp GA, et al. The leading causes of death after burn injury in a single pediatric burn center. Crit Care. 2009;13(6):R183. doi: 10.1186/cc8170.
- Woodson LC, Branski LK, Enkhbaatar P, Talon M. 17 - Diagnosis and Treatment of Inhalation Injury [Internet]. Fifth Edit. Total Burn Care. Elsevier Inc.; 2018.184-194.e3.doi:10.1016/B978-0-323-47661-4.00017-4
- Guo GH, Jiang ZY. [Pediatric inhalation injury]. Zhonghua Shao Shang Za Zhi. 2020;36(4):247–51. DOI: 10.3760/cma.j.cn501120-20191002-00393
- Lopez ON, Norbury WB, Herndon DN, Lee JO. 35 - Special Considerations of Age: The Pediatric Burned Patient. Fifth Edit. Total Burn Care. Elsevier Inc.; 2018. 372-380.e2 p.https://doi.org/10.1016/B978-0-323-47661-4.00034-4
- Enkhbaatar P, Sousse LE, Cox RA, Herndon DN. 16 - The Pathophysiology of Inhalation Injury [Internet]. Fifth Edit. Total Burn Care. Elsevier Inc.; 2018. 174-183.e4 p. https://doi.org/10.1016/B978-0-323-47661-4.00016-2
- Sommerhalder C, Blears E, Murton AJ, et al. Current problems in burn hypermetabolism. Curr Probl Surg. 2020;57(1):100709.doi:10.1016/j.cpsurg.2019.100709.
- Griffin BR, Frear CC, Babl F, et al. Cool Running Water First Aid Decreases Skin Grafting Requirements in Pediatric Burns: A Cohort Study of Two Thousand Four Hundred Ninety-five Children. Ann Emerg Med. 2020;75(1):75–85. doi: 10.1016/j.annemergmed.2019.06.028.
- Allorto NL. Primary management of burn injuries: Balancing best practice with pragmatism. S Afr Fam Pract. 2020;62(1):e1–4. doi: 10.4102/safp.v62i1.5202.
- Reeves LK, Savell SC, Maddry JK, et al. Prehospital Life-Saving Interventions Performed on Pediatric Patients in a Combat Zone: A Multicenter Prospective Study. Pediatr Crit care Med. 2020;21(7):e407–13. doi: 10.1097/PCC.0000000000002317.
- Sheridan RL. Sepsis in pediatric burn patients. Pediatr Crit care Med. 2005;6(3):112-9. doi: 10.1097/01.PCC.0000161577.27849.BE.
- Fairbrother H, Long M, Haines E. Optimizing emergency management to reduce morbidity and mortality in pediatric burn patients. Pediatr Emerg Med Pract. 2020;17(Suppl 6-2):1–51. PMID: 26011952.
- Khan A, Parikh M, Minhajuddin A, Williams T, et al. Opioid prescribing practices in a pediatric burn tertiary care facility: Is it time to change? Burns. 2020;46(1):219–24. doi: 10.1016/j.burns.2019.07.016
- Sofia J, Ambardekar A. Pediatric burn resuscitation, management, and recovery for the pediatric anesthesiologist. Curr Opin Anaesthesiol. 2020;33(3):360–7. doi: 10.1097/ACO.0000000000000859.
- Greenhalgh DG. Burn resuscitation: the results of the ISBI/ABA survey. Burns. 2010;36(2):176–82. doi: 10.1016/j.burns.2009.09.004.
- Jullien, S. Prevention of unintentional injuries in children under five years. BMC Pediatr,2021;21(1). https://doi.org/10.1186/s12887-021-02517-2
- Greenhalgh DG. Burn resuscitation. J Burn care Res . 2007;28(4):555–65. doi: 10.1097/bcr.0b013e318093df01.
- Klein MB, Hayden D, Elson C, Nathens AB, Gamelli RL, Gibran NS, et al. The association between fluid administration and outcome following major burn: a multicenter study. Ann Surg. 2007;245(4):622–8. doi: 10.1097/01.sla.0000252572.50684.49.
- Shah A, Pedraza I, Mitchell C, Kramer GC. Fluid volumes infused during burn resuscitation 1980-2015: A quantitative review. Burns. 2020;46(1):52–7. doi: 10.1016/j.burns.2019.11.013
- Branski LK, Herndon DN, Byrd JF, Kinsky MP, Lee JO, Fagan SP, et al. Transpulmonary thermodilution for hemodynamic measurements in severely burned children. Crit Care. 2011;15(2):R118. doi: 10.1186/cc10147.
- Salinas J, Chung KK, Mann EA, Cancio LC, Kramer GC, Serio-Melvin ML, et al. Computerized decision support system improves fluid resuscitation following severe burns: an original study. Crit Care Med. 2011;39(9):2031–8. Doi: 10.1097/CCM.0b013e31821cb790
- Charvillat O, Plancq M-C, Haraux E, Gouron R, Klein C. Epidemiological analysis of burn injuries in children during the first COVID-19 lockdown, and a comparison with the previous five years. Ann Chir Plast Esthét. 2021;66(4):285-90. https://doi.org/10.1016/j.anplas.2021.06.001
- Faraklas I, Lam U, Cochran A, Stoddard G, Saffle J. Colloid normalizes resuscitation ratio in pediatric burns. J Burn care Res.2011;32(1):91–7. doi: 10.1097/BCR.0b013e318204b379.
- Müller Dittrich MH, Brunow de Carvalho W, Lopes Lavado E. Evaluation of the “Early” Use of Albumin in Children with Extensive Burns: A Randomized Controlled Trial. Pediatr Crit care Med a J Soc Crit Care Med World Fed Pediatr Intensive Crit Care Soc. 2016;17(6):e280-6. DOI: 10.1097/pcc.0000000000000728
- Palmieri TL, Warner P, Mlcak RP, Sheridan R, Kagan RJ, Herndon DN, et al. Inhalation injury in children: a 10 year experience at Shriners Hospitals for Children.J Burn care Res. 2009;30(1):206-8. doi:10.1097/BCR.0b013e3181923ea4.
- Glas GJ, Horn J, van der Hoeven SM, Hollmann MW, Cleffken B, Colpaert K, et al. Changes in ventilator settings and ventilation-induced lung injury in burn patients-A systematic review. Burns. 2020;46(4):762–70. doi: 10.1016/j.burns.2019.05.015.
- Thompson KB, Dawoud F, Castle S, Pietsch JB, Danko ME, Bridges BC. Extracorporeal Membrane Oxygenation Support for Pediatric Burn Patients: Is It Worth the Risk? Pediatr Crit care Med. 2020;21(5):469–76. doi: 10.1097/PCC.0000000000002269.
- Myriam Galfo, Andrea De Bellis, Francesca Melini. Nutritional therapy for burns in children. J Emerg Crit Care Med 2018;05(12)1-5. http://dx.doi.org/10.21037/jeccm.2018.05.11
- Antoon AY. Quemaduras [Internet]. 21th Edition. Nelson. Tratado de pediatria. Elsevier España, S.L.U.; 2020. 614–623 p. http://dx.doi.org/10.1016/B978-84-9113-684-2/00092-3
- Cambiaso-Daniel J, Malagaris I, Rivas E, Hundeshagen G, Voigt CD, Blears E, et al. Body Composition Changes in Severely Burned Children During ICU Hospitalization. Pediatr Crit care. 2017;18(12):e598–605.doi:10.1097/PCC.0000000000001347.
- Shah, Amita R. Liao, Lillian F. Pediatric Burn Care. Clin Plastic Surg. 2017; 44(3):603-610. doi: 10.1016/j.cps.2017.02.017.
|

