Introducción
En 1886 el pediatra danés Harald Hirschsprung describió la enfermedad que hoy lleva su epónimo, denominada también angangliosis congénita. Es caracterizada por la ausencia de células ganglionares intramurales y la presencia de troncos nerviosos hipertróficos en el intestino distal, resultando en una obstrucción o suboclusión intestinal funcional, no mecánica(1) . La más temida complicación de la Enfermedad de Hirschsprung (EH) corresponde a la enterocolitis asociada.
Definición
La enterocolitis asociada a enfermedad de Hirschsprung (EAEH) es una entidad clínico-radiológica definida actualmente bajo los criterios de diarrea explosiva, distensión abdominal, vómitos o residuo gástrico bilioso y evidencia radiográfica de obstrucción intestinal y edema de la mucosa(2). Reconocida por Bunard en 1950, y por Swenson y Fisher en 1956, fue en 1962 cuando Bill y Chapman hacen la primera descripción como entidad aparte (3). Corresponde a la primera causa de muerte en pacientes con Enfermedad de Hirschprung (EH), pudiendo ocurrir antes del diagnóstico de la enfermedad, o después del tratamiento quirúrgico definitivo de ésta. Se asocia a mayor tiempo de hospitalización y los costos se elevan en 2,5 veces más que en los pacientes con EH sin enterocolitis (4).
Epidemiología
En términos epidemiológicos la EH se presenta en 1:5.000 recién nacidos. Del total de pacientes con EH, un 4,5 a 16% son portadores de Síndrome de Down (SD). La EAEH está presente antes del momento de la cirugía en un 15-50% de los pacientes con EH, y postoperatoria en un 2-33%, con una incidencia media del 25%(5). Las recurrencias alcanzan desde un 5,2 a un 41%, siendo mayor en pacientes con SD.
Fisiopatología
La fisiopatología de esta entidad no está completamente entendida. Revisaremos a continuación las teorías derivadas de la observación e investigación sobre EAEH.
Obstrucción mecánica
Bill y Chapman al momento de la descripción de esta entidad propusieron como teoría que la distensión mecánica de la pared intestinal por estasis fecal propiciaría isquemia de la mucosa, condición que podía ser revertida mediante colostomía(3). Sin embargo este planteamiento no explica que pueda haber enterocolitis en el segmento agangliónico, o incluso después de realizar la ostomía. Posteriormente se planteó que la EAEH postcirugía se generaba en parte por espasmos del esfínter anal interno. Estudios posteriores no encontraron diferencia en la manometría anal de pacientes post-operados que desarrollaron o no EAEH(6). Pero apoyan a esta teoría el éxito de la esfinterotomía externa y de la resección de segmentos con displasia neuronal intestinal (DNI), intervenciones que evitan la estasis fecal(7,8).
Infecciosa
Entre los agentes que se encontrarían involucrados en la patogenia de EAEH aparece Clostridium difficile mediante su toxina citopática, sin embargo estudios posteriores han sido inconsistentes(6). Otro agente infeccioso involucrado sería el Rotavirus, pero no se han podido validar estos resultados(9). Actualmente se cree que más que un agente específico, el desarrollo de EAEH estaría dado por la propensión a infecciones.
Alteraciones de la mucina
Se ha postulado que el estímulo bacteriano produce desregulación de la mucina en las células caliciformes, alterando el grado de sulfatación de esta sustancia, situación observada en enfermedades inflamatorias intestinales. Una pérdida del recambio de mucina condiciona una mala barrera mucosa que es capaz de ser vulnerada por los agentes infecciosos, prediciendo el desarrollo de EAEH (10). Un rol esencial lo jugaría la proteína MUC-2, disminuida en EAEH, así como una pérdida de la integridad de la mucosa por déficit de control en la proliferación y diferenciación, condicionada por regulación a la baja de los genes homeobox tipo caudal-1 y 2 (CDX-1 y CDX-2)(11). Hasta el momento las alteraciones de la mucina no han demostrado ser categóricamente causa o efecto, pero sus variaciones suponen la expresión de una barrera mucosa alterada en un intestino agangliónico.
Alteraciones inmunológicas
De manera similar, los estudios han encontrado un sustrato inmunológico, sin capacidad de establecer causa o efecto en la génesis de EAEH. Los resultados hallados evidencian para los neutrófilos reducción del conteo y deficiencia en sus capacidades de quimiotaxis y desgranulación. Además hay baja concentración intraluminal de IgA, en contraste con títulos elevados en la mucosa, correlacionado a aumento de plasmocitos y cadenas J (9). Otros hallazgos incluyen una disminución de las células neuroendocrinas en el intestino agangliónico de los pacientes que cursaron con EAEH, lo que correspondería a una respuesta inmune deficiente, que facilitaría la iniciación de la inflamación(12). También hay metaplasia de las células de Paneth, presentes normalmente en el intestino delgado y que son productoras de lisozimas, sugiriendo un intento por reforzar la inmunidad de la mucosa(13).
Otras teorías que han intentado explicar la patogénesis de la EAEH son: reacción de hipersensibilidad a endotoxinas (fenómeno de Shwartzman); déficit de sucrasa-isomaltasa; inmadurez de las células de la cripta; y displasia neuronal intestinal tipo B (8,13).
Hasta la fecha, no existe consenso en cuanto a la etiología de EAEH. Se reconoce como parte de una compleja interacción de factores genéticos y ambientales que derivan en el deterioro del sistema inmunológico en individuos genéticamente susceptibles.
Factores de riesgo
Dentro de los factores de riesgo estudiados se menciona el diagnóstico retardado, sin embargo esto no ha sido consistente en otros estudios (4). Sí se ha demostrado que a menor edad al diagnóstico de EH, mayor riesgo de EAEH postoperatoria (14). Otros factores estudiados reportan el sexo femenino, pero otros trabajos no han reportado resultados similares(15).
La trisomía 21, el desorden cromosómico más frecuente en EH, es un reconocido factor de riesgo(16). El 47% de los pacientes con SD y EH hacen EAEH. En pacientes con SD se ha establecido una deficiencia inmunológica intrínseca con disminución de la función citotóxica de los linfocitos-T y trastornos de la inmunidad humoral, situación que incrementa el riesgo de hacer EAEH. Es importante destacar que ciertos haplotipos del gen ITGB2 presente en el cromosoma 21, que codifica a CD18 (β2 integrina), promotora de la activación de los linfocitos-T, son asociados significativamente con EAEH(17).
La enfermedad de segmento largo constituiría otro factor de riesgo, que apoyada en la teoría de Bill y Chapman condiciona un aumento importante de la presión intraluminar, con estasis bacteriana y dilatación proximal. Estudios posteriores no muestran diferencia significativa. Además en pacientes con historia familiar, también postulado como condicionante, generalmente se asocian a enfermedad de segmento largo, sin establecer si son factores independientes. Sin embargo otras condiciones como la estenosis del sitio anastomótico representan un factor de riesgo real, que apoyaría la teoría citada(4). Los estudios no han encontrado que ciertos tipos de cirugías tengan mayor riesgo de presentar enterocolitis(18).
Anatomía Patológica
Desde el reconocimiento de esta patología realizado por Harald Hirschsprung ya había una descripción de las alteraciones provocadas por la enterocolitis asociada a este cuadro: ulceración completa que llega hasta la serosa, formación de abscesos submucosos y espacios moteados en la submucosa que contienen pus.
A la microscopía óptica es posible observar infiltración de neutrófilos en las criptas intestinales (criptitis) y formación de abscesos de las criptas, tanto en colon normal como agangliónico. Esto produce retención de mucus con dilatación de las criptas. La evolución natural de los abscesos de las criptas seguida de la progresiva ulceración de la mucosa puede llevar a necrosis transmural y perforación. Las etapas tardías son indistinguibles de la colitis ulcerativa. Teitelbaum formuló un sistema de graduación histológica para la EAEH(19) (Tabla 1).

Cuadro clínico
El cuadro clínico clásico en el neonato se inicia con historia de constipación desde el nacimiento con eliminación ocasional de heces malolientes y distensión abdominal progresiva. Hay que tener en cuenta que la diarrea está presente en el 16-33% de los pacientes con EH.
La patología progresa con la aparición de fiebre (12-54%), diarrea líquida, explosiva y de mal olor (93%), dolor abdominal cólico, letargia y eventual pasaje de heces sanguinolentas (5-9%).
El diagnóstico se hace en base a la historia más el examen físico: abdomen distendido y timpánico a la percusión (32-83%), y a la estimulación rectal eliminación violenta de gases y diarrea.
Si el cuadro progresa puede llevar a deshidratación y shock. Sin embargo la complicación más temida es el megacolon tóxico, que se caracteriza por vómitos biliosos, fiebre, deshidratación, distensión abdominal marcada y signos de shock. La imagen radiológica muestra asas colónicas gravemente dilatadas. Afortunadamente la perforación intestinal es una complicación infrecuente que afecta al 2-3% de los pacientes (20).
El diagnóstico diferencial debe hacerse con cuadros como gastroenteritis, obstrucción intestinal por bridas, formación de absceso intraabdominal y enterocolitis necrotizante.
Radiología
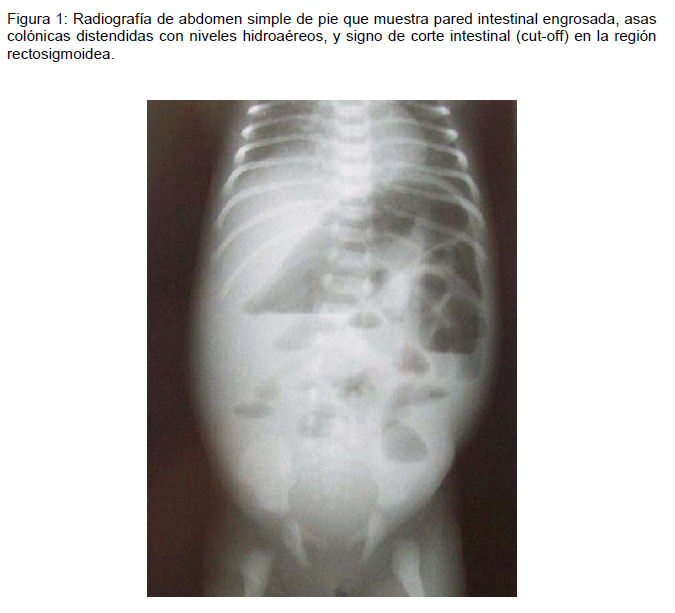
Las imágenes habituales de EAEH muestran asas colónicas distendidas, a menudo asociadas a dilatación o presencia de niveles hidroaéreos en intestino delgado. Además es posible ver engrosamiento e irregularidad de la pared intestinal. En caso de perforación se apreciará pneumoperitoneo. En algunas ocasiones se verá neumatosis intestinal, llevando a confusión con enterocolitis necrotizante. Se puede ver el signo de corte intestinal (cut-off) en la región rectosigmoidea, mediante interrupción brusca de la distensión gaseosa y ausencia de aire a distal (Figura 1). Este último hallazgo tiene una sensibilidad del 74% y una especificidad del 86% (21).
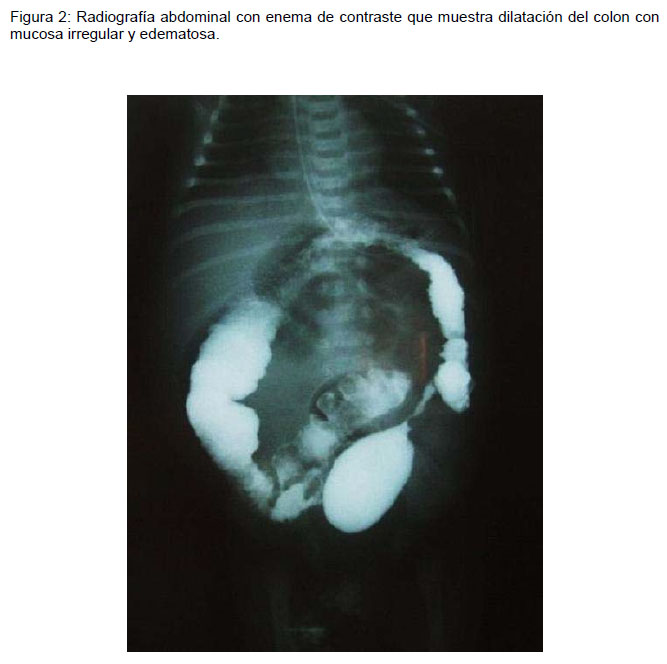
El enema de contraste muestra una mucosa irregular, ulceraciones, edema, estrechez de la unión anorrectal y dilatación colónica (Figura 2). Al igual que la biopsia rectal, no se recomienda realizar durante la fase aguda de la EAEH por el riesgo de perforación.
Prevención
En un principio se asumió que el mejor tratamiento para la EAEH era la prevención, por lo cual la colostomía debía hacerse en todos los niños apenas se hiciera el diagnóstico de EH. Actualmente esta posición se ha ido abandonando. Las alternativas actuales son la irrigación rectal frecuente, que es capaz de prevenir la enterocolitis, tanto pre como post-operatoria. Jugaría un rol tanto por la descompresión del intestino como por barrer con ciertos patógenos (22). Además el rol de la cirugía laparoscópica en la disminución del trauma quirúrgico juega un factor favorable para la prevención post-operatoria(4). Otras estrategias incluirían el uso de antibióticos profilácticos en biopsias rectales con grado histológico ≥ III(19), y la resección de segmentos con DNI tras el mapeo colónico como posibilidad de reducción de la EAEH postoperatoria (8).
Tratamiento
Se inicia con la formación de un equipo multidisciplinario en el tratamiento del paciente. Lo más importante es la resucitación agresiva con fluidoterapia para mantener el equilibrio hidroelectrolítico.
Debe descomprimirse el intestino mediante sonda nasogástrica e irrigación rectal. Para ello se aspiran gases y heces con irrigaciones de 20 a 50 mL de solución salina tibia, con un volumen total a usar de 100 a 150mL. En niños mayores pueden necesitarse 500 a 1000 mL. Deben hacerse dos a tres veces por día, teniendo en cuenta que durante la fase aguda pueden causar perforación. No deben usarse enemas fosfatados porque pueden empeorar el cuadro por toxicidad del fosfato.
Si no es posible descomprimir el intestino mediante lavados, debe practicarse una ostomía en la zona proximal a la región de transición. En ocasiones puede requerirse una colectoctomía total. Debe iniciarse régimen cero y nutrición parenteral cuando la enfermedad se prolongue. Hay que
cubrir con antibióticos de amplio espectro, idealmente metronidazol o vancomicina para atacar a Clostridium difficile, los cuales se pueden administrar por vía nasogástrica o por el estoma.
Otras sugerencias derivadas de algunas hipótesis o trabajos experimentales incluyen: Saccharomyces boulardii contra las toxinas de Clostridium difficile; probióticos a fin de disminuir la translocación bacteriana al modular la producción de mucina; uso de colestiramina para quelar las toxinas de Clostridium difficile y PGE1, que aumenta la secreción de agua y electrolitos en el yeyuno; y uso de cromoglicato de sodio (agente no absorbible estabilizador de los mastocitos) para EAEH recurrente (6,13).
La esfinterotomía interna deja buenos resultados. Es apoyada por un trabajo reciente en el cual los pacientes con malos resultados tras las cirugías eran clasificados como incontinentes o quienes desarrollaban enterocolitis. La respuesta estaría dada porque el daño al esfínter era contrario a la formación de estasis(7).
Las técnicas laparoscópicas no están exentas de riesgo de EAEH postoperatoria. La enterocolitis severa es una contraindicación para la cirugía asistida por video-laparoscopía. Durante esta intervención, a fin de evitar enterocolitis en el futuro, al resecar la zona aganglionar se sugiere extender la resección colónica unos 10 a 20 cms sobre la zona de transición, medida avalada por reducir la presencia de DNI en el segmento ganglionar proximal(8,23). Existe reticencia para realizar procedimientos en un tiempo quirúrgico en pacientes con SD, prefiriéndose alternativas más conservadoras como estomas(24). Sin embargo otras series clínicas demuestran que es posible realizar procedimientos definitivos primarios de manera segura y eficaz sin incrementar riesgos, incluido EAEH (25).
Resultados
La mortalidad por EAEH ha caído desde un 30% a un 1% en los últimos 15 a 20 años por los avances en cuidados intensivos neonatales, diagnóstico precoz, descompresión rectal, resucitación vigorosa y uso de antibióticos. Sin embargo sigue ocupando el primer lugar de causal de muerte en pacientes con EH, tanto a nivel pre como postoperatorio, aunque los peores resultados los obtiene el grupo que desarrolla EAEH antes de la intervención quirúrgica(26).
La mayoría de los pacientes con EAEH siguen teniendo alteraciones intestinales relacionadas, incluso años después de la cirugía. Las complicaciones más frecuentes incluyen aquellas que son observadas en los pacientes con EH que no desarrollan enterocolitis, tales como pobre control intestinal, constipación e incontinencia anal (soiling). En pacientes con SD los resultados difieren de quienes no portan esta condición por las otras morbilidades asociadas, principalmente anomalías cardiacas, lo cual repercute en la mortalidad. Además la función intestinal normal se ve empobrecida por la baja motivación y habilidad de estos pacientes.
El 39% desarrolla enterocolitis postoperatoria(24). El rol de la cirugía mínimamente invasiva en resultados funcionales a largo plazo debe esperar al menos 10 a 15 años para ser evaluada (27).
Proyecciones
La principal manera de avanzar en la reducción de la morbilidad asociada a la EAEH, tal como se ha hecho al disminuir la mortalidad, es mediante el desarrollo de investigación. De esta forma, este año han aparecido nuevos modelos animales que abren posibilidades a futuros resultados para aumentar el entendimiento sobre esta patología(28). Asimismo, los alcances que podemos esperar de la genética son el estudio de la fisiopatología en modelos animales, identificar mutaciones específicas y conferir conocimiento para el cuidado clínico de estos pacientes, y mediante la identificación de mutaciones y polimorfismos hacer consejería genética y test prenatales(29).
Referencias
- Shen DH, Shi CR, Chen JJ, et al. Detection of intestinal bifidobacteria and lactobacilli in patients with Hirschsprung's disease associated enterocolitis. World J Pediatr. 2009 Aug;5(3):201-5.
- Pastor AC, Osman F, Teitelbaum DH, et al. Development of a standardized definition for Hirschsprung's -associated enterocolitis: a Delphi analysis. J Pediatr Surg. 2009 Jan;44(1):251-6.
- Bill AH, Chapman ND: The enterocolitis of Hirschsprung's disease. Am J Surg 103:70-74, 1962.
- Hackam DJ, Filler RM, Pearl RH. Enterocolitis after the surgical treatment of Hirschsprung's disease: risk factors and financial impact. J Pediatr Surg. 1998 Jun;33(6):830-3.
- Vieten D, Spicer R. Enterocolitis complicating Hirschsprung's disease. Semin Pediatr Surg. 2004 Nov;13(4):263-72.
- Rintala RJ, Lindahl H. Sodium cromoglycate in the management of chronic or recurrent enterocolitis in patients with Hirschsprung's diease. J Pediatr Surg. 2001 Jul;36(7):1032-5.
- Levitt MA, Dickie B, Peña A. Evaluation and treatment of the patient with Hirschsprung disease who is not doing well after a pull-through procedure. Semin Pediatr Surg. 2010 May;19(2):146-53.
- Estevão-Costa J, Fragoso AC, Campos M, et al. An approach to minimize postoperative enterocolitis in Hirschsprung’s disease. J Pediatr Surg. 2006 Oct;41(10):1704–7.
- Imamura A, Puri P, O'Brian DS, et al. Mucosal immune defence mechanisms in enterocolitis complicating Hirschsprung's disease. Gut. 1992 Jun;33(6):801-6.
- Aslam A, Spicer RD, Corfield AP. Turnover of radioactive mucin precursors in the colon of patients with Hirschsprung's disease correlates with the devellpment of enterocolitis. J Pediatr Surg. 1998 Jan;33(1):103-5.
- Lui VC, Li L, Sham MH, et al. CDX-1 and CDX-2 are expressed in human colonic mucosa and are down-regulated in patients with Hirschsprung's disease associated enterocolitis. Biochim Biophys Acta. 2001 Sep 28;1537(2):89-100.
- Soeda J, O'Briain DS, Puri P. Mucosal neuroendocrine cell abnormalities in the colon of patients with Hirschsprung's disease. J Pediatr Surg. 1992 Jul;27(7):823-7.
- Murphy F, Menezes M, Puri P. Chapter 10. Enterocolitis complicating Hirschsprung’s disease in Hirschsprung's Disease and Allied Disorders. Holschneider AM, Puri P. (Eds.) Third Edition. Springer-Verlag Berlin Heidelberg 2008.
- Haricharan RN, Seo JM, Kelly DR, et al. Older age at diagnosis of Hirschsprung disease decreases risk of postoperative enterocolitis, but resection of additional ganglionated bowel does not. J Pediatr Surg. 2008 Jun;43(6):1115-23.
- Menezes M, Puri P. Long-term outcome of patients with enterocolitis complicating Hirschsprung's disease. Pediatr Surg Int. 2006 Apr;22(4):316-8. Epub 2006 Feb 4.
- Ieiri S, Higashi M, Teshiba R, et al. Clinical features of Hirschsprung's disease associated with Down syndrome: a 30-year retrospective nationwide survey in Japan. J Pediatr Surg. 2009 Dec;44(12):2347-51.
- Moore SW, Sidler D, Zaahl MG. The ITGB2 immunomodulatory gene (CD18), enterocolitis, and Hirschsprung's disease. J Pediatr Surg. 2008 Aug;43(8), 1439-44.
- Surana R, Qumn FMJ, Pmi P: Enterocolitis complicating Hirschsprung’s disease. Pediatr Surg Int 9.238-241. 1994
- Teitelbaum DH, Caniano DA, Qualman SJ. The pathophysiology of Hirschsprung’s-associated enterocolitis: importance of histologic correlates. J Pediatr Surg 1989; 24:1271–77.
- Sherman JO, Synder ME, Weitzman JJ, et al. A 40-year multinational retrospective study of 880 Swenson procedures. J Pediatr Surg. 1989 Aug;24(8):833-8.
- Elhalaby EA, Coran AG, Blane CE, et al. Enterocolitis associated with Hirschsprung's disease: a clinical-radiological characterization based on 168 patients. Teitelbaum J Pediatr Surg. 1995 Jan;30(1):76-83.
- Marty TL, Seo T, Sullivan JJ, et al. Rectal irrigations for the prevention of postoperative enterocolitis in Hirschsprung's disease J Pediatr Surg. 1995 May;30(5):652-4.
- Georgeson KE, Robertson DJ. Laparoscopic-assisted approaches for the definitive surgery for Hirschsprung's disease. Semin Pediatr Surg. 2004 Nov;13(4):256-62.
- Menezes M, Puri P. Long-term clinical outcome in patients with Hirschsprung's disease and associated Down's syndrome. J Pediatr Surg. 2005 May;40(5):810-2.
- Hackam DJ, Reblock K, Barksdale EM, et al. The influence of Down's syndrome on the management and outcome of children with Hirschsprung's disease. J Pediatr Surg. 2003 Jun;38(6):946-9.
- Murthi GV, Raine PA. Preoperative enterocolitis is associated with poorer long-term bowel function after Soave-Boley endorectal pull-through for Hirschsprung's disease. J Pediatr Surg. 2003 Jan;38(1):69-72; discussion 69-72.
- Rintala RJ, Pakarinen MP. Outcome of anorectal malformations and Hirschsprung's disease beyond childhood. Semin Pediatr Surg. 2010 May;19(2):160-7.
- Zhao L, Dhall D, Cheng Z, et al. Murine model of Hirschsprung-associated enterocolitis II: Surgical correction of aganglionosis does not eliminate enterocolitis. J Pediatr Surg. 2010 Jan;45(1):206-11; discussion 211-2.
- Mundt E, Bates MD. Genetics of Hirschsprung disease and anorectal malformations. Semin Pediatr Surg. 2010 May;19(2):107-17.
|

