Introducción
La espina bífida o mielomeningocele en una malformación congénita no letal, y corresponde a la alteración más común secundaria a defectos de cierre del tubo neural. Se define como una protrusión de la médula espinal y/o meninges a través de un defecto de los arcos vertebrales. Los niños nacidos con este defecto requieren neurocirugía en los primeros días de vida y tienen secuelas que incluyen diversos grados de parálisis motora y sensorial, alteraciones musculoesqueléticas y de funcionamiento vesical e intestinal, según el nivel del defecto.
En EE.UU en la actualidad afecta aproximadamente a 3,4 por 10.000 nacidos vivos, lo que se traduce en 1.500 nacidos vivos cada año.1 Se estima que la supervivencia a 1, 10 y 20 años de edad es 71%, 69% y 66%, respectivamente.2
La incidencia de defectos del tubo neural en Chile hasta el año 2000 era de 17 por 10.000 recién nacidos vivos y de 8.7 para espina bífida exclusivamente. Después de la implementación del Programa de Fortificación de Harinas con Ácido Fólico, el año 2000, se ha reducido a una tasa estimada de 7,8 y 3,9 por 10.000 en recién nacidos vivos y muertos, con peso igual o mayor a 500 grs. En nuestro país tenemos 260.000 recién nacidos vivos cada año, por lo tanto, podemos esperar 166 casos nuevos anuales.3
Esta revisión de la literatura médica intenta actualizar conocimientos, basados en evidencia disponible, en relación al diagnóstico, prevención y manejo prenatal de la espina bífida.
Prevención
En 1981, Laurence publica el primer ensayo doble ciego randomizado para evaluar prevención de recurrencia de defectos de cierre del tubo neural usando ácido fólico. Si bien el número de estudiados fue relativamente pequeño (44 con ácido fólico y 51 con placebo), en el grupo de estudio no hubo afectados comparado con los 6 casos en grupo control, diferencia estadísticamente significativa.4 Diez años después, este hallazgo se confirma con un estudio más grande del Medical Research Council Vitamin Study, informando un porcentaje de protección de 72 % (riesgo relativo 0.28, 95% IC 0.12-0.71).5 Czeizel et al. en 1992 aporta conocimiento sobre el beneficio de prevención primaria en pacientes sin factores de riesgo con el uso de ácido fólico (22.9 por 1000 vs. 13.3 por 1000, P = 0.02).6 En 1993, basado en evidencia disponible, el Centro de Control y Prevención de Enfermedades en Estados Unidos hace las recomendaciones de uso de ácido fólico vigentes hasta el día de hoy.7
Desde 1998 en USA y desde el año 2000 en Chile existe fortificación obligatoria por ley de ácido fólico en la harina de trigo.8 Hay estudios en Estados Unidos, Canadá que describen una disminución entre un 33 y 53 % de los casos de espina bífida desde la implementación de la fortificación de la harina.9,10 En nuestro país en el año 2004, Hertrampf y Cortés informan una caída de un 40% de los casos de espina bífida, luego del primer año de fortificación de la harina.11 La guía del MINSAL, de 2011 para el diagnóstico y tratamiento de las disrafias espinales, recomienda tanto la fortificación de la harina con ácido fólico, como la suplementación en los casos de riesgo.3
Existe una conocida asociación entre uso de anticonvulsivantes y espina bífida, sobre todo ácido valproico y carbamazepina en el primer trimestre del embarazo. Un metaanálisis de Gilboa en 2011 describe un odds ratio para ácido valproico de 11,9 (95%, 4.0-21.2) y para carbamazepina de 3,6 (95%, 1.3-7.8)12. Un estudio japonés en 2013, informa como factor de riesgo importante para aparición de espina bífida el uso de fármacos antiepilépticos (OR, 20·20; 95% CI, 2.06-198.17).13
En suma y considerando la evidencia disponible del punto de vista preventivo, son recomendaciones actuales, las siguientes:
- A nivel de prevención poblacional, se sugiere enriquecer con ácido fólico la harina de trigo.
- Suplementar con 4 mg/día de ácido fólico a mujeres con factores de riesgo 2 meses antes y en primer trimestre de embarazo programado.
- Suplementar con 4 mg/día de ácido fólico a mujeres con factores de riesgo, que no aseguren el control de su fertilidad.
- En mujeres que no consuman alimentos fortificados con ácido fólico, con deseo de embarazo suplementar con ácido fólico 1 mg/día.
- Evitar, en la medida de lo posible, el uso de carbamazepina y ácido valproico, en mujeres que deseen embarazarse.
Diagnóstico
Un diámetro biparietal pequeño (BPD) se ha asociado con la espina bífida abierta en ultrasonido a las 11-14 semanas. Karl informa que DBP bajo percentil 10 a las 11-14 semanas debería considerase marcador de espina bífida.14 Bernard, encontró que el 50% de los fetos con espina bífida abierta tienen un DBP bajo el percentil 5 en evaluación ecográfica de primer trimestre.,15
Chaoui describe la translucidez intracraneal (TI) en evaluación 11-14 semanas como marcador precoz de espina bífida. En un estudio retrospectivo, el 100% de los fetos con una translucidez intracraneal normal fueron normales, por lo que esta evaluación podría descartar espina bífida abierta.16 La TI aumenta linealmente con el aumento de la longitud céfalo-nalgas, es fácil de identificar y medir y muestra excelentereproducibilidad intra e inter observadores.17 El examen del primer trimestre de la fosa posterior se ha perfeccionado aún más, agregando la medición el tronco cerebral y su distancia al hueso accipital, que han sido identificados como posibles signos de cribado de primer trimestre para la espina bífida abierta.18 Estás mismas mediciones se han evaluado con tecnología 3D con resultados similares.19 Por lo anterior, todas las pacientes que se realicen estudio ultrasonogáfico fetal entre las 11 y 14 semanas se debe intentar detectar estos marcadores de espina bífida abierta, especialmente la presencia/ausencia translucidez intracraneal. (Figura 1).
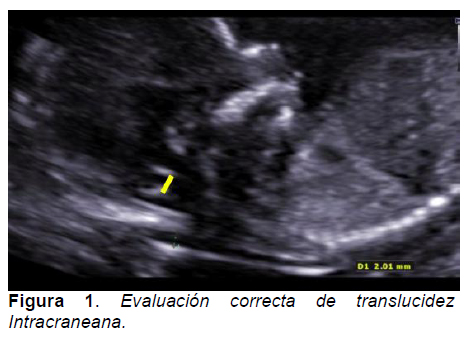
La confirmación definitiva de espina bífida se basa también en estudio ultrasonográfico en el segundo trimestre del embarazo. Los ya clásicos hallazgos cerebelares y craneales vistos en la ecografía (signo del plátano y signo del limón) asociados con la malformación de Chiari II fueron descritos por Nicolaides en 1986, donde se realizó un estudio de imágenes retrospectivo, evaluando 70 casos de espina bífida con ecografía realizada entre las semanas 16 y 23. En los 54 casos con obtención de imagen para medición de DBP se observó signo del limón, y en 12 de los 21 casos con imagen de fosa posterior se obtuvo signo del plátano. En esta misma publicación, mostró que los fetos con un mielomeningocele abierto tienen un diámetro biparietal por debajo del percentil 5 en el 61% de los casos y una circunferencia craneana también bajo el percentil 5 en el 26 %.20
Van den Hof identificó que el 95 % de los fetos con espina bífida presentaban anormalidades cerebelares independiente de la edad gestacional.
En fetos de hasta 24 semanas predominaba el signo de la banana (72%), mientras que en el grupo de mayor edad predominaba la ausencia cerebelar (81%). El signo del limón estaba presente en el 98 % de los fetos de 24 semanas o menos, pero en sólo el 13 % de los fetos más de 24 semanas.21
En 234 fetos con alto riesgo de espina bífida (AFP alterada), mostraron que el 99% tenía al menos un hallazgo craneal a las 24 semanas o menos. Los signos del limón, plátano o cerebelo ausente se observaron tanto en el 97% de fetos, ventrículomegalia en el 75%, cisterna magna ausente en el 68% y diámetro biparietal reducido en el 61%.22
Lennon, en una población de alto riesgo encontró para el ultrasonido una sensibilidad del 97% (66 de 68) (95%, IC 0.898, 0.996) y 100% de especificidad (n= 2189) (IC 0,998, 1.0) para el diagnóstico de defectos del tubo neural abierto.23
Por lo tanto, el Gold Standard actual es la ultrasonografía para el diagnóstico de espina bífida. En toda evaluación, se debe dirigidamente buscar esta anomalía y/o sus signos indirectos.
Se debe intentar ser lo más preciso posible en localizar el nivel de lesión en los casos de espina bífida. En 1996, Cochrane describió los resultados neonatales e infantiles, incluyendo la morbilidad quirúrgica, los patrones de deambulación, continencia vesical e intestinal y el rendimiento escolar, por nivel de la lesión, en 85 niños diagnosticados con espina bífida abierta y tratados en el período neonatal 1971-1981. Se evaluaron retrospectivamente las imágenes de ultrasonido prenatal de 26 de estos niños, encontrando que el nivel de la lesión podría clasificarse correctamente como toraco-lumbar, lumbar y sacra, según el nivel más bajo comprometido. El resultado funcional es variable, pero se relaciona con el nivel de la disrafia espinal y el déficit neurológico resultante.24 Biggio estudió el nivel de la lesión mediante ecografía bidimensional para predecir la deambulación a los 2 años de edad en 33 casos de diagnóstico prenatal de espina bífida abierta. Los investigadores encontraron que el nivel de la lesión en la ecografía prenatal fue concordante con el diagnóstico postnatal en un 92% de los casos (dos vértebras de diferencia). No hay casos con lesiones
torácicas que pudieran deambular, 50 % de los casos con lesiones L1-L3 pudieron hacerlo al igual que el 100% de los casos de lesión L4-S3.25
Actualmente, cada día se hace más frecuente el uso de tecnología 3D. Esta modalidad ultrasonográfica se recomienda para complementar el estudio de estas pacientes, ya que es útil en mejorar la exactitud de diagnóstico del nivel de lesión espinal. La ecografía tridimensional puede proporcionar excelentes imágenes de una lesión de médula espinal. El Instituto Americano de Ultrasonido en Medicina destaca entre los beneficios de diagnóstico de la ecografía obstétrica 3D, la definición más exacta del nivel superior de la lesión e identificación anomalías vertebrales.26 Una revisión exhaustiva de la literatura de Gonçalves, concluye beneficios específicos de la ecografía 3D en el examen del cerebro fetal y la columna vertebral.27 Un estudio turco del año 2013 evalúa el papel de la ecografía tridimensional (3D) en la detección prenatal del polo superior de lesión en fetos con espina bífida. 48 casos fueron estudiados, con una tasa de concordancia exacta con la evaluación postnatal de 79% (38/48). En los 10 fetos restantes, se encontró que tenían un nivel de la lesión que estaba dentro del segmento de la lesión informado.28
El uso de la RM fetal se ha convertido en una importante herramienta de complemento para perinatólogos y neurocirujanos pediátricos para ayudar en el asesoramiento y la planificación quirúrgica de los fetos diagnosticados con espina bífida en la ecografía.29 Mangels demostró la capacidad de caracterizar con precisión el nivel de mielomeningocele en uno o dos niveles vertebrales en el 89% de los casos mediante resonancia magnética.30 Las características de tamaño de mielomeningocele y el nivel afectado basado en la RNM se correlacionan con los resultados pediátricos, como la deambulación, la función de la vejiga, la escoliosis y la disfagia.31 En comparación con la ecografía, la resonancia magnética parece ser igual de precisa para la predicción del nivel de la vértebra más alta afectados.32
Es conocida y bien documentada la asociación entre aneuploidía y defectos de cierre del tubo neural, pero no existe consenso absoluto en cuanto a la necesidad de realizar estudio cromosómico en todos los embarazos con este diagnóstico. Sin embargo, se debe considerar que la normalidad o anormalidad cromosómica tiene marcada incidencia en el pronóstico y en el manejo de cada caso. El estudio ecográfico detallado del resto de la anatomía fetal realizado correctamente puede orientar a la presencia o ausencia de aneuploidías.33
Manejo
Cirugía Prenatal
La reparación de mielomeningocele fetal en humanos por histerotomía se realizó por primera vez en 1997, y al año 2003 había más de 200 casos descritos. Los primeros datos sugerían una mejoría importante en la disminución de herniación de cerebro posterior en comparación con controles históricos, pero también mostró un aumento de riesgo materno incluyendo trabajo de parto prematuro y dehiscencia uterina, además de un aumento sustancial de riesgo de muerte fetal-neonatal y parto prematuro.34,35
El MOMS (Management of Myelomeningocele Study) es una ensayo randomizado controlado realizado entre los años 2003 y 2010. Los pacientes fueron randomizados a cirugía fetal antes de las 26 semanas o cirugía tradicional post natal. El resultado primario a evaluar fue mortalidad fetal y neonatal compuesta, y la necesidad de instalación de válvula derivativa de líquido cefalorraquídeo antes de los 12 meses de vida. El ensayo fue interrumpido por la eficacia de la cirugía prenatal después de reclutar 183 casos de los 200 planificados. Se analizó el resultado en 158 pacientes evaluados a los 12 meses. Los parámetros evaluados primariamente se produjeron en el 68% de los niños con cirugía prenatal y en el 98% de aquellos con cirugía postnatal (riesgo relativo, 0,70; IC 97,7%, 0,58-0,84; P <0,001). La necesidad de instalación de válvula derivativa fue de 40% en el grupo de cirugía prenatal y 82% en el grupo de cirugía postnatal (riesgo relativo, 0,48; IC 97,7%, 0,36-0,64; P <0,001). Dentro de los resultados secundarios evaluados, destacan en el grupo de cirugía prenatal, una mejoría en la puntuación compuesta de desarrollo mental y función motora a los 30 meses (p = 0,007), disminución de hernia de cerebro posterior a los 12 meses, y la mejoría de deambulación a los 30 meses. Sin embargo, la cirugía prenatal se asoció con un aumento del riesgo de parto prematuro y dehiscencia uterina durante el parto.36
En publicación reciente, en 100 casos manejados después de publicación de MOMS y siguiendo sus protocolos, los resultados fueron comparables con los previamente descritos.37
En suma, el tratamiento quirúrgico fetal en casos seleccionados y en centros de experiencia tiene ventajas respecto al tratamiento quirúrgico postnatal.
Los defectos de cierre del tubo neural, en nuestro país corresponden a una patología GES (garantías explícitas en salud). En última guía MINSAL sobre el tema, del año 2011, según opinión de expertos, en nuestro país, parece recomendable limitarse al cierre postnatal.3 En casos seleccionados, con padres informados y como protocolo de estudio podría ofrecerse cirugía fetal para espina bífida.
Para la ACOG, los riesgos y beneficios de la reparación prenatal debe ser discutido con toda mujer que califique en base a los criterios de MOMS. La intervención debe ser únicamente realizada en instituciones con la experiencia e infraestructura adecuada para proporcionar un alto nivel de atención.38 Los pacientes deben ser informados sobre la opción quirúrgica prenatal y si corresponde, referirlos a un centro con experiencia e infraestructura especializada.39
En nuestro medio existe una experiencia aún no publicada, liderada por el Dr. Waldo Sepúlveda, incluyendo pacientes tanto del área pública como privada (clínica Las Condes y Hospital Regional de Rancagua) iniciada en Septiembre de 2011, con 26 casos a la fecha con resultados promisorios, pero aún con índices de prematuridad severa y mortalidad perinatal superiores a los publicados en el estudio MOMS. Esto se explicaría por criterios de selección menos estrictos que en el estudio original.40
En relación a la cirugía fetoscópica para espina bífida, podemos decir que aún está en etapa de desarrollo. Las experiencias publicadas son con series pequeñas, no demuestran claros beneficios y no han logrado controlar problemas como la prematuridad asociada e importantes dificultades técnicas.41
Vía de Parto
En relación a la vía de parto existe la creencia que la cesárea es la siempre la opción recomendable, sin embargo, la evidencia no es categórica. En estudiorealizado en Washington en 1991, sobre 200 casos, se comparó el resultado neonatal entre cesárea antes de iniciarse el trabajo de parto (47), cesárea una vez iniciado el trabajo de parto (35) y parto vaginal (78). A los dos años de edad, los bebés que habían estado expuestos a trabajo de parto tenían 2,2 veces más parálisis severa que aquellos nacidos por cesárea sin trabajo de parto (IC 95%, 1.7 - 2.8). Los bebés nacidos por cesárea antes del comienzo del trabajo de parto tuvieron una media de nivel de parálisis 3,3 +/- 3,0 segmentos por debajo del nivel anatómico de la lesión de la médula a los dos años de edad, en comparación con 1,1 +/- 2,3 para los bebés nacidos parto vaginal y 0,9 +/- 4,1 para los nacidos por cesárea después del comienzo del trabajo de parto (p<0,001 para ambas comparaciones). El trabajo de parto no afectó a la frecuencia de las complicaciones neonatales o el rendimiento intelectual posterior. Concluyeron que para el feto con mielomeningocele sin complicaciones asociadas, el parto por cesárea antes del inicio del trabajo de parto puede dar lugar a una mejor función motora posterior.42 En otro estudio en 1998 se analizaron todos los fetos (n = 60) con mielomeningocele nacidos Iowa entre 1971 y 1995. Treinta y seis casos tenían seguimiento de largo plazo de seguimiento. No hubo diferencias significativas en grupos analizados. No hubo diferencia en el resultado neurológico a largo plazo evaluado por diferencias en el nivel de alteración del motora y sensorial, o al comparar el nivel de alteración motora con el nivel anatómico de lesión. Este estudio no fue capaz de detectar diferencias entre resultados inmediatos y a largo plazo para el niño con mielomeningocele aislado cuando se estratificó por la vía del parto.43 Existe un estudio de cohortes retrospectivo de los embarazos únicos complicados con mielomeningocele en California entre 2005 y 2008. Los resultados evaluados incluyeron la muerte neonatal, síndrome de dificultad respiratoria, taquipnea transitoria del recién nacido, hemorragia intraventricular, enterocolitis necrotizante, meningitis, y muerte infantil. 507 pacientes se incluyeron en el para el estudio. No hubo diferencias significativas en la mortalidad neonatal, la mortalidad infantil, el síndrome de dificultad respiratoria o la meningitis entre los recién nacidos obtenidos por cesárea en comparación con los partos vaginales. El parto por cesárea se asoció con tasas significativamente más altas de la taquipnea transitoria del recién nacido (6,6 % frente a un 2,1 %, P = 0,032) y hemorragia intraventricular (2,5 % frente a 0 %, P = 0,029) en comparación con el parto vaginal.44 En 2004 un estudio retrospectivo de cohortes de pacientes con mielomeningocele seguidos hasta 10 años o más. Se comparó el estado de deambulación (independiente, con asistencia, o en silla de ruedas) a los 2 y 10 años, en nacidos por cesárea electiva versus aquellos pacientes sometidos a trabajo de parto. Hubo 44 pacientes en el grupo de cesárea electiva y 43 en la de trabajo de parto. No hubo diferencias significativas en la edad gestacional al momento del parto o el peso al nacer entre los grupos. No hubo diferencia estadística entre los 2 grupos cuando se compararon los niveles de alteración motora y anatómicas, iniciales y actuales. En comparación con el grupo de cesárea electiva, los pacientes del grupo de trabajo de parto tuvieron mejor resultado al evaluar deambulación a los 2 años (independiente 7% v/s 28%, con asistencia del 63% v/s 65%, o en silla de ruedas de 30% v/s 7% , P = 0,003) y a los 10 años (independiente 5% v/s 21%, ambulante, con asistencia de 30% v/s 54%, o en silla de ruedas de 65% versus 25%, P < 0,001). Sin embargo, al realizar análisis de regresión logística, considerando el nivel de alteración motora del mielomeningocele, no se observó ninguna asociación significativa en cuanto a la deambulación a los 2 y 10 años entre los niños nacidos por cesárea electiva o después de trabajo de parto.45
La tendencia predominante hasta hoy ha sido la resolución por cesárea. Actualmente, la mejor alternativa para los casos individuales es la que de mayor seguridad a la madre y a los médicos tratantes. Cualquiera sea la decisión en cuanto a la vía de parto, todos los nacimientos debieran realizarse en un hospital que tenga el equipo de profesionales especializados y una unidad de neonatología preparada para recibir al recién nacido con espina bífida. La guía ministerial nacional para el manejo de disrafias espinales recomienda como vía de parto la cesárea en todos los casos.3
Referencias
- Boulet SL, Yang Q, Mai C, et al. Trends in the postfortification prevalence of spina bifida and anencephaly in the United States. Birth Defects Res A Clin Mol Teratol 2008;82:527-32.
- Tennant PW, Pearce MS, Bythell M, Rankin J. 20-year survival of children bornwith congenital anomalies: a population-based study. Lancet 2010;375:649-56.
- Ministerio de Salud. Guía Clínica Disrafias Espinales, diagnóstico y tratamiento. Minsal, 2011.
- Laurence KM, James N, Miller MH, et al. Double-blind randomised controlled trial of folate treatment before conception to prevent recurrence of neural-tube defects. Br Med J 1981;282:1509–11.
- Anonymous. Prevention of neural tuve defects: results of the Medical Research Council Vitamin Study. MRC Vitamin. Study Research Group. Lancet 1991;338:131–7.
- Czeizel AE, Dudas I. Prevention of the first occurrence of neural-tube defects by periconceptional vitamin supplementation. N Engl J Med 1992;327:1832–5.
- Anonymous. From the Centers for Disease Control and Prevention. Recommendations for use of folic acid to reduce number of spina bifida cases and other neural tube defects. JAMA 1993;269:1236–8.
- Anonymous. Trends in wheat-flour fortification with folic acid and iron: worldwide, 2004 and 2007. MMWR Morb Mortal Wkly Rep 2008;57:8–10.
- Williams LJ, Mai CT, Edmonds LD, et al. Prevalence of spina bifida and anencephaly during the transition to mandatory folic acid fortification in the United States. Teratology 2002;66:33–9.
- De Wals P, Tairou F, Van Allen MI, et al. Reduction in neural-tube defects after folic acid fortification in Canada. N Engl J Med 2007;357:135–42.
- Hertrampf E, Cortes F. Folic acid fortification of wheat flour: Chile. Nutr Rev 2004;62:S44–8. discussion S49.
- Gilboa SM, Broussard CS, Devine OJ, Duwe KN, Flak AL, Boulet SL, Moore CA, Werler MM,Honein MA. 2011. Influencing clinical practice regarding the use of antiepileptic medications during pregnancy: Modeling the potential impact on the prevalences of spina bifida and cleft palate in the United States. Am J Med Genet Part C Semin Med Genet 157:234–246.
- Kondo A, Morota N, Ihara S, Saisu T, Inoue K, Shimokawa S, Fujimaki H, Matsuo K, Shimosuka Y, Watanabe T. Risk factors for the occurrence of spina bifida (a case-control study) and the prevalence rate of spina bifida in Japan. Birth Defects Res A Clin Mol Teratol. 2013 Sep;97(9):610-5. doi: 10.1002/bdra.23179.
- Karl K, Benoit B, Entezami M, et al. Small biparietal diameter in fetuses with spina bifida on 11-13 week and midgestation ultrasound. Ultrasound Obstet Gynecol 2012;40:140–4.
- Bernard JP, Cuckle HS, Stirnemann JJ, et al. Screening for fetal spina bifida by ultrasound examination in the first trimester of pregnancy using fetal biparietal diameter. Am J Obstet Gynecol 2012;207:306.e1–5.
- Chaoui R, Benoit B, Mitkowska-Wozniak H, et al. Assessment of intracranial translucency (IT) in the detection of spina bifida at the 11–13-week scan. Ultrasound Obstet Gynecol 2009;34:249–52.
- Begoña Adiego, Tamara Illescas, Pilar Martinez-Ten, Carmina Bermejo, Javier Perez-Pedregosa, Amy E. Wong and Waldo Sepulveda. Intracranial translucency at 11–13 weeks of gestation: prospective evaluation and reproducibility of measurements. Prenatal Diagnosis 2012, 32, 259–263
- Robert Lachmann1, Rabih Chaoui, Jose Moratalla, Gemma Picciarelli and Kypros H. Nicolaides. Posterior brain in fetuses with open spina bífida at 11 to 13 weeks. Prenat Diagn 2011; 31: 103–106.
- Scheier M, Lachmann R, Petros M, et al. Three-dimensional sonography of the posterior fossa in fetuses with open spina bifida at 11–13 weeks’ gestation. Ultrasound Obstet Gynecol 2011;38:625–9.
- Nicolaides KH, Campbell S, Gabbe SG, et al. Ultrasound screening for spina bifida: cranial and cerebellar signs. Lancet 1986;2:72–4.
- Van den Hof MC, Nicolaides KH, Campbell J, et al. Evaluation of the lemon and banana signs in one hundred thirty fetuses with open spina bifida. Am J Obstet Gynecol 1990;162:322–7.
- Watson WJ, Chescheir NC, Katz VL, Seeds JW. 1991. The role of ultrasound in evaluation of patients with elevated maternal serum alpha-fetoprotein: a review. Obstet Gynecol 78(1): 123–128.
- Lennon CA, Gray DL. Sensitivity and specificity of ultrasound for the detection of neural tube and ventral wall defects in a high-risk population. Obstet Gynecol 1999;94:562–6.
- Cochrane DD, Wilson RD, Steinbok P, et al. Prenatal spinal evaluation and functional outcome of patients born with myelomeningocele: information for improved prenatal counselling and outcome prediction. Fetal Diagn Ther 1996;11: 159–68.
- Biggio Jr JR, Owen J,Wenstrom KD, et al. Can prenatal ultrasound findings predict ambulatory status in fetuses with open spina bifida? Am J Obstet Gynecol 2001;185:1016–20.
- Benacerraf BR, Benson CB, Abuhamad AZ, et al. 2005. Three- and 4-dimensional ultrasound in obstetrics and gynecology: proceedings of the american institute of ultrasound in medicine consensus conference. J Ultrasound Med 24(12): 1587–1597.
- Goncalves LF, Lee W, Espinoza J, Romero R. 2005. Three- and 4-dimensional ultrasound in obstetric practice: does it help? J Ultrasound Med 24(12): 1599–1624.
- Selim Buyukkurt, Figen Binokay, Gulsah Seydaoglu, Umran Kucukgoz Gulec, Fatma Tuncay Ozgunen, Cuneyt Evruke, Cansun Demir. Prenatal Determination of the Upper Lesion Level of Spina Bifida with Three-Dimensional Ultrasound. Fetal Diagn Ther 2013;33:36–40.
- Zugazaga Cortazar A, Martin Martinez C, Duran Feliubadalo C, et al. Magnetic resonance imaging in the prenatal diagnosis of neural tube defects. Insights Imaging 2013;4:225–37.
- Mangels KJ, Tulipan N, Tsao LY, et al. Fetal MRI in the evaluation of intrauterine myelomeningocele. Pediatr Neurosurg 2000;32:124–31.
- Chao TT, Dashe JS, Adams RC, et al. Fetal spine findings on MRI and associated outcomes in children with open neural tuve defects. AJR Am J Roentgenol 2011;197:W956–61.
- Aaronson OS, Hernanz-Schulman M, Bruner JP, et al. Myelomeningocele: prenatal evaluation: comparison between transabdominal US and MR imaging. Radiology 2003;227:839–43.
- W. Sepulveda, E. Corral, C. Ayala, C. Be, J. Gutierrez and P. Vasquez. Chromosomal abnormalities in fetuses with open neural tube defects: prenatal identification with ultrasound. Ultrasound Obstet Gynecol 2004; 23: 352–356 Published online 3 February 2004 in Wiley InterScience (www.interscience.wiley.com). DOI: 10.1002/uog.964
|

