Introducción y epidemiologia
Como su nombre lo indica, la enfermedad de “Legg- Calvé- Perthes” fue descrita de forma independientemente hace más de un siglo atrás(1) por el americano Arthur Legg, cirujano ortopédico, Jacques Calvé, cirujano francés y Georg Clemens Perthes, cirujano alemán(2).
Se caracteriza por ser una forma idiopática de necrosis avascular de la cabeza femoral que lleva a la generación de osteocondrosis aséptica, condición que deteriora la osificación normal de la cabeza femoral. (3/4)
Es una patología relativamente común en la infancia, se describen cifras de ocurrencia de 10,8 por cada 100.000 niños en USA y a nivel mundial de 2 por cada 100.000, siendo su edad de presentación más frecuente entre los 3 y 7 años o los 4 y 8 años de edad, según la procedencia del estudio.(3/4/5)
Esta enfermedad les ocurre preferentemente a los varones, siendo su relación de 4:1 en comparación con mujeres de la edad, y en 10 a 15% de los casos se ha visto que la enfermedad puede ocurrir en ambas extremidades. Rara vez se presenta en ambas simultáneamente(3/4)
La enfermedad de Perthes ha sido asociada a varios factores, como por ejemplo a bajo nivel socioeconómico, condiciones ambientales y emocionales desfavorables, factores asociados a deprivación social como baja estatura y deficiencias dietarias u obesidad (65% de los pacientes se encuentran por encima del percentil 90 en las graficas de peso-edad), y tabaquismo pasivo(1/5), sin embargo no ha sido posible encontrar una etiología biológica probable. (2)
Algunas de las posibles explicaciones están relacionadas con alteraciones vasculares, traumas, condiciones constitucionales, alteraciones endocrinas y genéticas(3). Con respecto a este último punto, es importante aclarar que si bien los primeros estudios negaban una asociación genética de esta enfermedad, estudios recientes sugieren la posibilidad de que haya cierta predisposición hereditaria y además asociación racial, siendo más frecuente en caucásicos.(1)
La fisiopatología, clínica, radiología y progresión han sido difíciles de caracterizar, por ende ha sido aun más difícil, como decíamos, conocer la etiología(4), sin embargo, sí han surgido distintas formas de clasificar esta patología. La clasificación más utilizada es la “clasificación de Catterall” (1971), que consiste en medir la extensión de la fragmentación máxima a través de Rx antero-posterior y en posición de Lowenstein. Salter y Thompson (1984) simplificaron esta clasificación dividiendo las caderas en dos grupos(A: < de 50% de extensión y B: > de 50% de extensión), basándose en la extensión de la fractura subcondral que primero había sido descrita por Waldenström (1938). Herring et al. en 1992 presentaron una clasificación de tres grupos basándose en el grado de compromiso (altura) del pilar lateral de la cabeza femoral durante la fase de fragmentación.(6)
La enfermedad de Perthes toma cursos muy variables en su evolución, siendo factores de progresión la extensión del área necrótica y signos de riesgo de la cabeza femoral. Aproximadamente 50% de los pacientes progresaran a artritis y eventualmente sufrirán reemplazo de la cabeza femoral, (2) a pesar de su curación espontánea. (3)
Uno de los puntos más importantes que tiene que considerar el tratamiento es preocuparse de la deformación residual presente en los adolescentes y en la restauración de la anatomía normal. Con este objetivo, existen como opciones terapéuticas desde la observación y seguimiento, hasta la reconstrucción quirúrgica de la cadera, dejándose de lado, por evidencias recientes, el uso de órtesis para aliviar el peso de la extremidad.(4)
Hoy en día la enfermedad de Perthes es vista como una combinación de factores ambientales y genéticos, siendo multifactorial en su etiología, y al entenderse como tal los tratamientos tienen que ir dirigidos a prevenir deformidades, para evitar así, patologías osteo-artrósicas de las caderas.(4/7)
Etiología
Durante el siglo veinte, se creía que diferentes tipos de enfermedades infecciosas causaban esta enfermedad, postulándose que la oclusión arterial era la única causa. Ya a finales del siglo pasado y a comienzos de este, aparecieron teorías más complejas, que involucraban factores géticos y al medio. Durante el siglo pasado ocurrió un cambio epidemiológico importante, donde la globalización e industrialización provocó un cambio en las enfermedades que causan la mayor mortalidad dentro de la población, dando paso de aquellas infecciosas, a las de carácter crónicas degenerativas, genéticas y medio ambientales provocadas por el hombre.
Es por esto que la teoría infecciosa ha perdido fuerza y debido a esto es que se requieren nuevas herramientas para el estudio de la etiología de esta patología.
La enfermedad de Perthes pertenece a la clase de las osteocondrosis asépticas de la infancia. Se caracteriza por la necrosis avascular de la epífisis, en la cual no existe osificación endocondral de la cabeza femoral.
Su etiología específica permanece desconocida, pero se han propuesto varias causas, dentro de las que encontramos microtraumas repetidos, retraso en el crecimiento esquelético, e insuficiencia vascular. Su causa directa es la isquemia de la epífisis femoral capital que causa necrosis de la cabeza femoral. (6)
Se supone que los microtraumas repetidos de la cabeza femoral producen pequeñas fracturas en la trama esponjosa de la cabeza femoral inmadura. Esta hipótesis se apoya en la observación de esta enfermedad en los niños más hiperactivos.(8)
La teoría vascular se apoya en el hecho de que la perfusión sanguínea de la cabeza femoral deriva de vasos que adquieren un trayecto intra y extra articular en el cuello femoral, región que es especialmente vulnerable en los niños a esta edad. Se ha demostrado obstrucción mediante angiografía de las arterias capsulares superiores. Se han observado que alteraciones en la coagulación o en la viscosidad sanguínea, así como cambios en los vasos sanguíneos, pueden llevar a la necrosis de la epífisis ósea. Algunos estudios recientes apuntan a un estado de hipercoagulabilidad, que involucra deficiencia de las proteínas S y C e hipofibrinolisis. La teoría es que los coágulos en los capilares pueden producir los infartos vasculares. Demostrado por el hecho de que pacientes con enfermedades hematológicas (talasemia, anemia de células falciformes) comúnmente presentan necrosis avascular de la cadera.(9)
Anomalías en el drenaje venoso de la cabeza y cuello femoral también han sido reportados. El flujo venoso normal es generalmente a través de la vena circunfleja medial, sin embargo en pacientes con Perthes existe un aumento de la presión venosa, congestión venosa metafisiaria y drenaje a través de las venas diafisiarias más distales.
Además, la mayoría de los niños con la Enfermedad de Perthes, también manifiestan retardo en el crecimiento esquelético. Se ha demostrado que el cuociente urinario entre desoxipiridinolina/creatinina se encuentra anormalmente bajo en la fase de condensación de esta enfermedad, lo que nos indica que existe una hipoactividad en el metabolismo esquéletico durante este período y esto orienta a una causa sistémica de esta enfermedad.(10-11)
También se han observado asociación e niños con edad ósea menor a cronológica, talla corta, bajo peso al nacer, disminución de somatomedina C y alteraciones en los niveles séricos de tiroxina y triyodotironina.
Fisiopatología
Es importante conocer la historia natural de la enfermedad, ya que su pronóstico dependerá de que la cabeza femoral permanezca esférica cuando el paciente alcance la maduración esquelética, así que plantearse el tratamiento a establecer depende de que el médico sepa qué le pasará al paciente sin tratamiento y qué factores le harán tener un resultado adverso.
Dentro de los factores que mejoran el pronóstico encontramos la edad de presentación, ya que si la enfermedad se presenta en menores de 6 años la posibilidad de tener un mejor resultado es mayor. Pese a esto, el tener esta enfermedad por un largo tiempo y el gran período requerido para la maduración esquelética, hacen que se presenten puentes óseos en la fisis, que llevan a una deformación de la cabeza femoral. A esto se le suma una inadecuada inmovilización en los niños mayores que requieren mucha actividad, lo que facilita las fracturas cartilaginosas, lo que conlleva a un aplanamiento metafisiario.
No existen estudios adecuados de la historia de la enfermedad, solamente descripciones parciales a largo plazo como la de Catteral (12) que dividió a los pacientes en:
1. Fase Inicial, en que principia la fragmentación, es el período en que la cabeza femoral parece estar deformada.
2. Fase de Curación, en que parece ocurrir una osificación biológica de la cabeza femoral y puede durar hasta dos años
3. Fase de Crecimiento, en que puede haber remodelación.
Catteral utilizó para la valoración el sistema de gradiente de Sundt, (13) por un período de 10 años, tiempo que fue demasiado corto para tener resultados adecuados en el padecimiento y sus datos no son clasificables como criterios de tratamiento. A diferencia de él, Stulberg(14) también trató de completar un estudio parecido, sin lograr pronosticar el futuro de la cadera, para cambiar la alteración en la congruencia articular que da artrosis en la vida adulta temprana, que lleva a la necesidad de un reemplazo articular, necesidad que aumenta conforme avanza la edad y que más frecuentemente ocurre cuando esta se inicia después de los 8 a 9 años de edad.
Mose (15) desarrolló una escala de esfericidad de la cabeza femoral, tratando de pronosticar su futuro que no debe hacerse antes de que el paciente haya dejado de crecer; sin embargo podemos decir en forma general que los principales factores pronóstico para la mayoría de los autores son:
- La deformidad de la cabeza femoral
- La incongruencia articular de la cadera
- Edad de inicio
- Extensión del involucramiento epifisiario
- Alteración del crecimiento secundario al cierre fisiario prematuro
- Curso prolongado de la enfermedad
- Potencial de remodelación, tipo de tratamiento
- Fase de la enfermedad en que inició el tratamiento.
Phemister(16), en 1921 mostró mediante estudios histológicos, que le Enfermedad de Perthes es una necrosis ósea de la epífisis femoral capital con diferentes grados de afectación, evolución y reparación, en que la cobertura del cartílago articular se encuentra esencialmente sin afectación aunque adelgazada y fue confirmado posteriormente en 1928 por Zemansky(17). Los estudios de Waldenström (18-19) permitieron dividir para su comprensión, el curso de la necrosis y reparación en cuatro estadios característicos: Necrosis (Inicial), Resorción (Fragmentación), Reosificación y Remodelación.
En resumen, y juntando los hallazgos más importantes descritos por cada autor, podemos señalar que esta enfermedad se divide en:
Etapa inicial de Necrosis
Mediante la realización de biopsias del centro de la cabeza femoral afectada, Jonsäter(20) encontró que en esta etapa existe isquemia que causa necrosis del hueso y de la médula ósea. Las trabéculas pueden estar destruidas y/o aplastadas. Los núcleos de los osteocitos están picnóticos o ausentes, se forma una masa de hueso desorganizado, muerto, que se acumula en la médula ósea sustituyéndola, hay zonas ocasionales de hueso sano, pero sin evidencia de regeneración ósea. Hay un cese temporal de la osificación endocondral y no hay formación de núcleo de osificación.
La placa basal de cartílago muestra cambios degenerativos en que predominan áreas en donde hubo necrosis que llega hasta la unión cartílago-hueso, pudiendo dejar huecos.
La capa de cartílago periférico se adelgaza, ya que hay una continua proliferación celular local que continúa nutriéndose del líquido sinovial, mientras la fisis de crecimiento presenta irregularidades, ya que la falta de aporte sanguíneo da alteraciones en la alineación de sus células, limitando su aposición en columnas.
En esta etapa la cabeza femoral es muy vulnerable a las fuerzas que actúan sobre ella, pudiendo deformarla o causar fracturas subcondrales que hundan el cartílago, aunque podría conservar su contorno esférico.(20)
Etapa de resorción o Fragmentación
En esta segunda etapa, el estrés que causó el problema continúa ejerciéndose en la cadera y el hueso necrótico se aplastará y comprimirá, el cartílago puede hundirse, las fracturas subcondrales han ocurrido, pero los osteoclastos inician su actividad, participando en una remodelación de las trabéculas distorsionadas, realizan una sustitución por infiltración y aposición, empiezan por un fibrocartílago que rellena los defectos, esto lo hacen de una manera irregular, primero desde la periferia de la epífisis. Este tejido conectivo con vascularidad invade el hueso necrótico, mientras los osteoclastos lo reabsorben, reemplazándolo por un hueso nuevo inmaduro; como se presenta de manera infiltrativa y por haber repetido períodos de infartos óseos, suele tener diferentes grados de maduración en el mismo hueso. Esto también causa cambios similares acompañantes en el cartílago.
Los colapsos óseos, su fragmentación y la reparación del hueso, causan pérdida de altura de la epífisis y se inicia una osificación endocondral. El hueso necrótico colapsado se revasculariza, generalmente primero en la región antero-lateral y aparecen zonas osificadas en el cartílago articular, que en las radiografías se ven áreas de calcificación que son uno de los signos de riesgo de Catterall y en la porción supero-lateral aparece una protrusión que se llama “signo de Gage”, la cual es una extrusión lateral de la cabeza femoral que sobresale del acetábulo.
Al principio de la etapa de resorción, el trabeculado de la metáfisis puede ser esencialmente normal, pero la parte central de la metáfisis puede contener tejido adiposo, que en etapas posteriores estas áreas radiolúcidas corresponderán histológicamente a fibrocartílago que dan una osificación desorganizada, así la fisis puede extenderse sobre la metáfisis desde el cuello femoral.
La compresión vertical o el estrés continuo sobre la cabeza femoral que tiene hueso muerto, inmaduro o sustituido por tejido más suave, puede causar colapso del cartílago que no tiene un cimiento resistente, dando aplastamiento de la epífisis, generalmente en dirección antero-lateral y queda una cabeza femoral plana, extruida, deformada o de forma ovalada. (21)
Fase de Reosificación
Podemos decir que el período de fragmentación o resorción termina cuando el tejido fibrovascular que ha sustituido al hueso necrótico inicia una fase de maduración ósea (reosificación) de reparación (este período también puede llamarse de reparación).
Al persistir fuerzas de compresión en la cadera, por contracturas musculares, soporte del peso corporal o alguna posición inadecuada de la cabeza femoral en el fondo acetabular, ocurren fracturas que colapsan el hueso avascular patológico, que lentamente, de forma infiltrativa, se sustituye por aposición de un hueso viable, dando esclerosis y condrificación por metaplasia del tejido fibroso reactivo formado en la zona y facilitando la función de los osteoclastos, que reabsorben el hueso necrótico; esto radiográficamente se ve como un aumento de la radiolucidez.
La reosificación generalmente inicia en los márgenes de la epífisis y progresa hasta que la epífisis está completamente osificada; se trata de una reosificación parafisiaria y ésta es la razón por la que puede haber la formación de puentes óseos entre la metáfisis y la fisis, que dan bloqueos de crecimiento del cuello femoral; de esta forma hay una reosificación transfisiaria también. (12-21-22)
Fase de Remodelación
La revascularización ósea involucrada en la Enfermedad de de Perthes es muy lenta debido a que la destrucción de sus trabéculas causa compresión y bloqueo de los canales vasculares de los capilares óseos y medulares; se dice que existe una segunda etapa de necrosis isquémica, por el bloqueo vascular que da la compresión por impacto, apisonamiento y acumulación de escombros de hueso necrótico. Pero una vez que la epífisis se ha reosificado, la cabeza femoral se va remodelando poco a poco, hasta que el paciente alcanza la madurez esquelética. La recuperación de la esfericidad de la cabeza femoral dependerá del aplanamiento existente, de la cantidad de extrusión ósea que tenga, de la concentricidad de los componentes de la cadera y de las fuerzas biomecánicas que actúen en ella, pero frecuentemente el resultado final puede ser una cabeza femoral y acetábulo no esféricos (Coxa Plana) o deformados, por lo que esta etapa también puede llamarse fase de deformidad residual. (21-22)
Bowen reportó que el tiempo de duración de cada etapa puede variar mucho en cada caso, pero en general la etapa de necrosis y resorción dura 6 meses, la de reosificación de 18 meses a tres años y la de remodelación hasta la maduración esquelética. (23)
Los cambios radiológicos generalmente corresponden con las etapas de evolución de Waldenstrom. Los primeros corresponden a: disminución del tamaño del núcleo secundario de osificación de la cabeza femoral, aumento del espacio articular y aumento de la intensidad de la cabeza femoral. En la etapa tardía de esta primera etapa aparece una fractura subcondral (que sirve de base para la clasificación de Salter-Thompson), la que puede hacerse aparente.
Durante la etapa de fragmentación se aprecia colapso y extrusión de la cabeza femoral. La severidad de los cambios radiológicos y el cuadro clínico generalmente se correlacionan. Generalmente durante esta etapa los síntomas son más severos.
Finalmente, durante la etapa de reosificación se inicia una nueva producción de hueso subcondral de reparación y los síntomas se hacen menos intensos.
Clínica
La presentación de la enfermedad, suele ser muy insidiosa y poco clara, aparece típicamente en niños entre los 3 a 7 años de edad. Afecta más a niños que a niñas, en una proporción de 4:1.
Generalmente son los padres los que notan claudicación al caminar, que muy pocas veces saben cuándo se inició. Ésta puede ser de unas semanas a varios meses. Esta cojera es antálgica, de zancadas y fases de apoyos cortos, que aumenta con el ejercicio y disminuye con el reposo. Pocas veces tiene como antecedente una sinovitis tóxica y el 70% refieren un traumatismo previo. El dolor suele no ser incapacitante, localizándose mayoritariamente en la región inguinal y se presenta durante la actividad física. En aproximadamente un 25% de los pacientes, el dolor se irradia a la región del muslo y la rodilla del mismo lado, siguiendo la trayectoria del nervio obturador. Puede existir una discreta atrofia del muslo y la nalga.
Es por lo anterior que en aquellos niños que consultan por dolor de rodilla asociado a cojeo, generalmente son diagnosticados en forma más tardía. Es por esto que en todo niño que consulta por gonalgia debe tener un examen físico de cadera adecuado. Entre el 10% a 15% de los niños con esta patología van a tener compromiso de ambas caderas, generalmente en forma escalonada e infrecuentemente de manera simultánea. (24-25)
El examen físico generalmente revela cojeo a la marcha. Al palpar al paciente podemos encontrar contractura de los músculos aductores, así como del psoas ilíaco, con movilización pasiva dolorosa y limitada. Al tratar de palpar la cabeza femoral se puede causar dolor por la sinovitis existente. Posteriormente puede desarrollarse contractura en flexión de la cadera, permaneciendo la pierna en aducción y rotación lateral; en este momento hay restricción de la rotación medial de la cadera, puede acompañarse de signo de Trendelenburg positivo y discreta asimetría de la longitud de las piernas. Bowen reportó que en el 75% de los casos el diagnóstico se realiza durante la fase de necrosis o fragmentación. La movilidad de la cadera se encontrará limitada, sobretodo en la rotación interna y la abducción. Además, las piernas van a tener una longitud diferente, debido a la contractura en aducción o al colapso de la epifisis comprometida. (23)
Existen ciertos factores que pueden disminuir la sospecha de esta enfermedad encontrando entre ellos, la presentación a edad tardía, sobrepeso, limitación severa del rango articular y sexo femenino de la paciente. Pese a esto, frente a la clínica descrita, el médico tratante debe tener la sospecha de esta patología, dado la importancia pronostica que posee el diagnóstico precoz.
Diagnóstico
La sospecha de enfermedad de Perthes se realiza através de la clínica y el examen físico, el que tendrá elementos más llamativos luego de realizar ejercicio. Podremos encontrar:
- Limitación de los movimientos de la cadera, en especial la rotación interna. En las fases iniciales la limitación de la abducción se debe a sinovitis y a contractura muscular de los aductores, sin embargo con el tiempo aparecen deformaciones que podrían llevar a la limitación de la abducción permanente
- Ligera contractura en flexión de cadera de unos 10-20 grados
- Atrofia de los músculos del muslo, pantorilla o nalga causados por el dolor
- Dismetría en extremidades inferiores por contractura de aducción o por acortamiento verdadero a causa del colpaso de la cabeza femoral o de inhibición del crecimiento (5).
MÉTODOS DE ESTUDIO
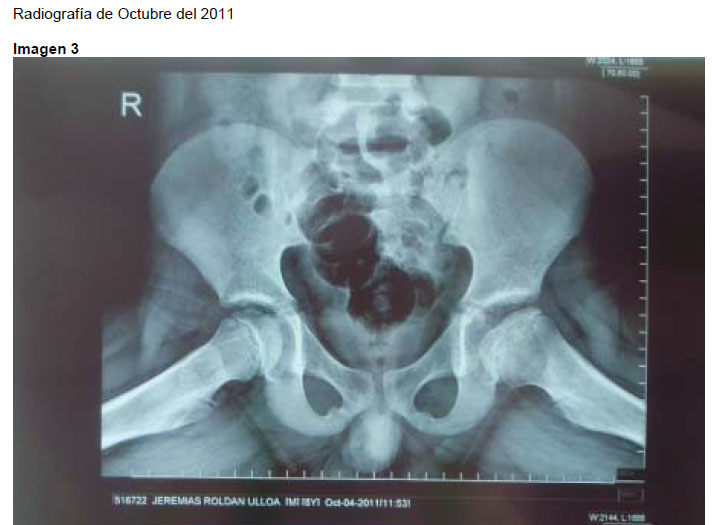
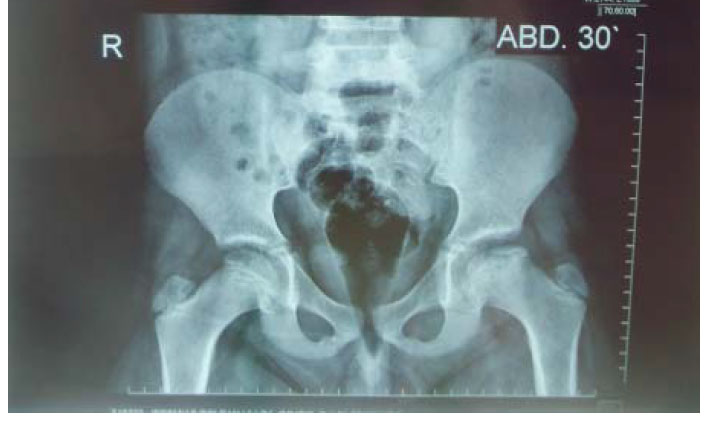
a. Radiografía. El primer estudio que se realiza es la radiografía de pelvis. Visiones antero posterior y lateral de Lawenstein permiten establecer el diagnostico, estadificar, realizar pronósticos, seguimiento y valorar los resultados(5). (ver anexo 1: caso clínico)
b. Gammagrafía. En ausencia de cambios en la radiografía, principalmente en etapas precoces, se pueden realizar otros estudios, como gammagrafía de tecnecio-99 que puede mostrar avascularidad de la cabeza femoral (5).
c. Ecografía. Le ecografía es útil para encontrar cambios en la cabeza femoral y para establecer la presencia de sinovitis o derrame articular (4).
d. Resonancia magnética (RM). La RM es útil en los casos en que no se observan cambios en la radiografía simple en etapas tempranas de la enfermedad y en casos en que el diagnostico diferencial se dificulte(4). Es muy sensible para infarto óseo, pero no muestra con precisión las fases de reparación (5).
Sin embargo, la RM no ha mostrado tener valor pronóstico, por lo que no se utiliza como una técnica de diagnóstico habitual(4). La RM se utiliza comúnmente para realizar el diagnóstico diferencial en casos en que se sospecha enfermedad de Perthes y se cuenta con imágenes radiográficas negativas o equivocadas. En estos casos la RM generalmente muestra una causa inesperada de dolor (26).
e. Artrografía. La RM dinámica, como la artrografía, podría mostrar abduccion en visagra de la pierna (el borde lateral de la cabeza femoral contacta con el borde acetabular) en el estudio preoperatorio (4), y aplanamiento de la cabeza femoral.
SISTEMAS DE CLASIFICACIÓN
A través del tiempo se han planteado diversas clasificaciones a partir de las imágenes radiológicas.
a. Clasificacion de Legg. En una primera instancia se clasifico según Legg, que describió una deformación tipo copa y una tipo hongo(27).
b. Esquema de Waldenström. el esquema de Waldenström, en el que se reconocen las etapas inicial, condensación, fragmentación, reparación y curación(28).
- En la fase inicial se observa disminución del tamaño del núcleo de osificación, lateralización de la cabeza femoral, ensanchamiento del espacio articular medial, fracturas subcondrales e irregularidades de la fisis.
- En la fase de fragmentación la epífisis se observa fragmentada con áreas radiotransparentes y radiopacas.
- En la fase de reosificación se observa densidad ósea normal, por la formación de nuevo hueso trabecular.
- Por último, en la fase residual, se observa reosificación de la cabeza femoral, remodelación progresiva de la cabeza femoral hasta la madurez esquelética y remodelación del acetábulo(5).
c. Clasificación de Goff. En 1950, Goff describió tres tipos: esférico, copa e irregular(27).
d. Clasificación de Catterall. En 1971(1), Catterall inició con la clasificación moderna de la enfermedad de Perthes. Propuso una clasificación en cuatro tipos, con los dos primeros asociados a buen pronóstico y los 2 últimos a un pronóstico pobre(27). Para esta clasificación Catterall se baso en el grado de compromiso de la cabeza femoral, y suplementó esta clasificación con un término que denomino “signos de cabeza en riesgo"(4).
- Las caderas tipo I tiene afección anterior de un 25%, sin presencias de secuestros ni alteraciones metafisiarias.
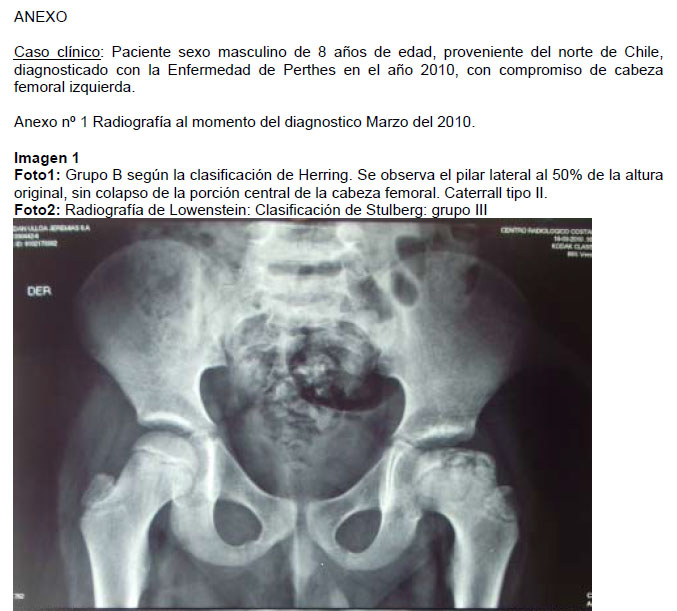
- Las caderas tipo II presentan una afección del 50%, con clara demarcación entre segmentos sanos y enfermo. (imagen 1 foto 1)
- Las caderas tipo III muestran afectación del 75%, con secuestros de gran tamaño.
- Las caderas tipo IV tienen compromiso de toda la cabeza (5).
Entre los signos de “cabeza en riesgo” se encuentran el signo de Gage (radiolucencia en la parte lateral de la epífisis y la metáfisis), calcificación lateral a la epífisis, subluxación lateral de la cabeza femoral y horizontalización de la fisis (27).
Los resultados de la clasificación de Catterall han sido muy difíciles de reproducir inter-observador. Hardcastle et al. encontraron que la clasificación tenia escasa fiabilidad, pero mayor precisión si se combinaran los grupos II y III. Christensen et al. encontraron poco acuerdo inter-obervador incluso al combinar los grupos II y III. Van Dam et al. señalaron que la clasificación cambiaba frecuentemente durante el curso de la enfermedad cuando se había aplicado antes de la fase de fragmentación(27).
e. Clasificación de Salter y Thompson. En 1984, Salter y Thompson describieron una clasificación que involucraba 2 grupos, los que eran definidos según la extensión de la fractura subcondral (que se corresponde con la magnitud de la resorción subsecuente) en una radiografía axial en etapas tempranas de la enfermedad. La desventaja de esta clasificación es que no todos los casos se diagnostican en etapas tempranas (4).
- En el grupo A está afectada menos de la mitad de la cabeza femoral (grupo I y II de Catterall). Hay presencia de columna lateral viable, lo que puede proteger a la epífisis de un colapso y subsecuente deformidad.
- En el grupo B está afectada más de la mitad de la cabeza femoral (grupo III y IV de Catterrall). Ausencia de columna de epífisis viable(5).
Mukherjee y Fabry encontraron buena correlación entre la clasificación de Salter y Thompson y los resultados y la clasificación de Catterall. Sin embargo, Wiig et al. no encontró acuerdo inter-observador en esta clasificación (27).
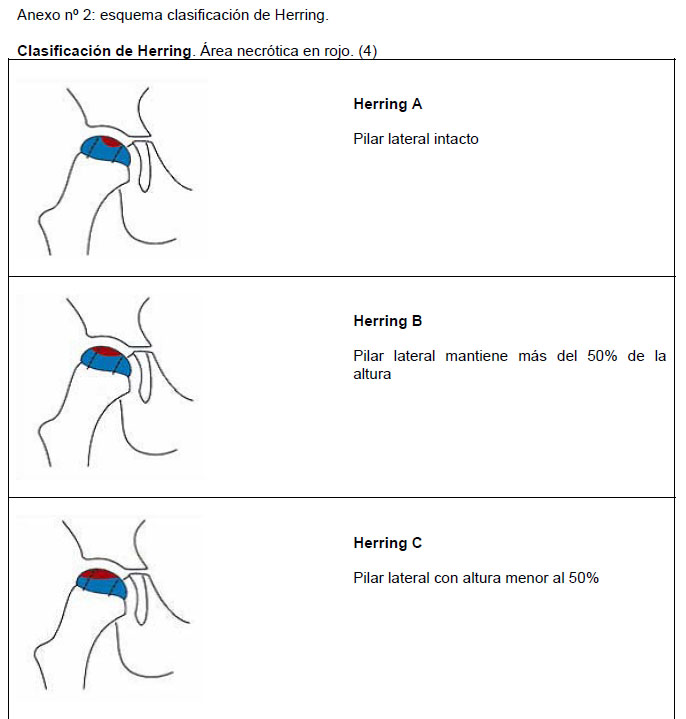
f. Clasificación de Herring. En 1992 se propuso de clasificación de Herring, que es la que se utiliza actualmente, que se basa en la altura de los pilares laterales de la epífisis de la cabeza femoral (porción lateral de la cabeza femoral), como se ve en una proyección AP de rayos X en la fase de fragmentación temprana(27). En esta clasificación la cadera se divide en 3 secciones o pilares(5). (ver anexo 2: esquema clasificación de Herring)
- El pilar lateral está constituido por el 15-30% lateral del ancho de la cabeza femoral.
- El pilar central está constituido por el 50% del ancho de la cabeza femoral
- El pilar medial por el 20-35% del ancho de la cabeza(5).
El grado de afectación del pilar lateral se divide en 3 grupos:
- En el grupo A, el pilar lateral se encuentra radiológicamente normal
- En el grupo B el pilar lateral muestra alguna radiolucencia, pero mantiene más del 50% de la altura (imagen 1, foto 1).
- En el grupo C (imagen 1, foto1), el pilar lateral es más transparente y la altura es menor al 50%(5)
Sin embargo se ha añadido un nuevo grupo a su clasificación, el B / C "grupo de la frontera", porque su estudio multicéntrico reveló que muchas caderas afectadas tenían un aspecto radiológico es intermedio entre los tipos B y C(4). Este grupo se caracteriza por tener un pilar lateral muy estrecho (2 a 3 mm de ancho) mayor al 50% de la altura original, un pilar lateral con pequeñas osificaciones pero al menos 50% de la altura original o un pilar lateral de exactamente el 50% de la altura original, que este deprimido en relación al pilar central, (27).
Cuando se encuentra en fase temprana tiene mayor valor pronóstico y fiabilidad que la clasificación de Catterall. El valor predictivo de la clasificación de Herring es mayor cuando la edad del paciente al inicio de la enfermedad también se considera(4).
Comparando la clasificación de Catterall y la clasificación de Herring, se demostró que la primera tiene un mejor valor pronóstico pero a su vez tiene menos reproducibilidad (42% comparado con la clasificación de Herring que tiene un 80%).(29), menor fiabilidad y menor validez, especialmente en niños menores de 6 años. Las mayores dificultades en la clasificación de Catterall se ven la entro los grupos II y III (28).
g. Clasificación de Stulberg. Ha sido efectiva para predecir cambios posteriores de artritis degenerativa. Se clasifica en cinco grupos, dependiendo de la esfericidad y congruencia de la cabeza femoral del acetábulo (30).
- El grupo I se define como una cadera completamente normal.
- El grupo II se define como una cabeza femoral esférica, más grande que lo normal, un cuello femoral más corto o con anormalidades en la inclinación del acetábulo. Se observa menos de 2 mm de desviación de un círculo concéntrico en radiografías anteroposterior y Lowenstein.
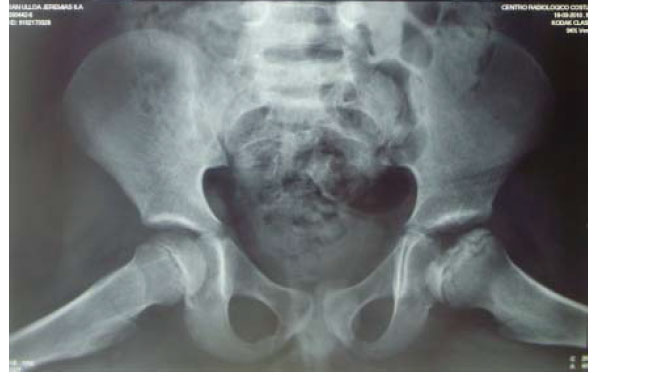
- El grupo III se caracteriza por tener una cabeza femoral no esférica, con forma ovoide, de champiñón o paraguas, pero no plana. Se observa más de 2 mm de desviación en un círculo concéntrico en radiografía anteroposterior o Lawenstein. (imagen 1, foto2)
- El grupo IV tiene la cabeza femoral y el acetábulo planos (al menos 1 cm de aplanamiento en la superficie articular (en la zona de soporte de peso).
- El grupo V tiene cabeza femoral plana y cuello femoral y acetábulo normales, es decir, ha perdido congruencia la cabeza femoral con el acetábulo(27).
Los pacientes en el grupo I y II tienen buen resultado a largo plazo. Los del grupo III y IV generalmente desarrollan artrosis degenerativa a largo plazo y los del grupo V desarrollan artrosis en los primeros cuarenta años(30).
Diagnóstico diferencial
Múltiples trastornos producen un cuadro clínico y/o radiológico similar a la enfermedad de Perthes. Sin embargo, muchas de estas enfermedades producen afección bilateral y simétrica, o se acompañan de una historia familiar, talla corta, afección a otras epífisis, etc., en contraste con la enfermedad de Perthes que es generalmente unilateral y en los casos en que es bilateral, la afección es asimétrica(30). Se debe sospechar diagnósticos diferenciales cuando no exista clínica ni progresión radiológica característica de la enfermedad de Perthes(4).
Entre los principales diagnósticos diferenciales se encuentran(4,30):
- Enfermedades hematológicas, como hemoglobinopatías, linfoma, leucemia, púrpura trombocitopénica idiopática, hemofilia.
- Displasia epifisiaria múltiple o espóndiloepifisiaria
- Enfermedad de Morquio
- Coxitis fugaz: cuando un paciente con edad típica de enfermedad de Perthes sufre una coxitis fugaz que persiste por semanas, se debe realizar radiografías o RM para descartar enfermedad de Perthes
- Artritis idiopática juvenil
- Osteomielitis
- Displasia de Meyer
- Condroblastoma
- Necrosis de la cabeza femoral inducida por corticoides
Otras enfermedades asociadas con osteonecrosis(4)
- Talasemia
- Trisomia 21
- Acondroplasia
- Enfermedad de Gaucher
- Hemofilia
- Hipotiroidismo
- Síndrome de Klinefelter
Tratamiento
Dada la amplia variabilidad en la presentación clínica y severidad de la enfermedad, es que existen también una amplia gama de opciones terapéuticas (30).
De este modo, los factores que van a condicionar la realización de uno u otro tratamiento son la edad del paciente, el grado de afectación y la subluxación(31).
Las metas terapéuticas a corto plazo en la ELCP son disminuir o hacer desaparecer el dolor y la rigidez coxales. A largo plazo es intentar conseguir una cabeza femoral que posea una forma lo más regular posible y una articulación con la mayor congruencia que se pueda conseguir, con el objeto de evitar la aparición posterior de artrosis degenerativa precoz(31).
Los principios del tratamiento, independiente del método empleado, son dos(32):
1.- Restaurar la movilidad articular: La restricción de la movilidad en estos pacientes es debido inicialmente a la sinovitis de la cadera que ocasiona contractura de los músculos abductores y psoas. Existen muchos métodos para mantener una buena movilidad articular como son el reposo en cama, tracción cutánea o la fisioterapia. Si estas medidas, tras 10-15 días de instaurarse, no son efectivas, ocasionalmente se pueden tratar las contracturas por medio de tenotomías.
2.- Mantener la cabeza femoral con una buena cobertura (Contención): Distribución uniforme de las presiones sobre la superficie de la cabeza femoral con cubrimiento completo por el acetábulo y sin que necesariamente haya restricción de la marcha. Agrupa métodos conservadores como las férulas y yesos de abducción y quirúrgicos, como las osteotomías pélvicas o femorales(33).
De acuerdo a un estudio multicéntrico realizado por la Pediatric Orthopedic Society of North America (POSNA), el protocolo del manejo terapéutico de la ELCP es(30):
- Todos los pacientes con afección del pilar lateral A (según la clasificación de Herring) y aquéllos con clasificación B menores a 6 años, son manejados en forma sintomática. Lo cual incluye control del dolor con antiinflamatorios no esteroideos, periodos de reposo o tracción para disminuir el dolor, sinovitis y espasmo muscular acompañante.
- Los pacientes mayores de 6 años con afección B del pilar lateral y todos los del grupo C, son manejados con cirugía para conseguir “contención” de la cabeza femoral por el acetábulo mayor. La mayoría de los pacientes requieren de algún tiempo de manejo sintomático para mejorar la movilidad de la cadera, antes de la cirugía.
- Pacientes mayores de 9 años con afección B o C del pilar lateral, pudieran beneficiarse de la combinación de la osteotomía del fémur proximal con una osteotomía de Salter. Sin embargo, el resultado es incierto en este grupo de pacientes.
Métodos de contención:
1.- No quirúrgicos: Una serie de aparatos entre los cuales destacan el de Toronto, el de Birmingham, el Newington, el de Tachdjian y el de Atlanta han sido utilizados con diversos grados de éxito(30). Hoy en día estos métodos de tratamiento están en desuso, ya que varios estudios han demostrado que no alteran favorablemente la evolución natural de la enfermedad. A lo anterior se le suma la incomodidad de su utilización, el prolongado uso que se requiere de los mismos, lo difícil que es establecer el momento de iniciar y suspender su uso, y el gran rechazo que existe de parte del paciente y sus familiares para utilizar este tipo de aparatos. (imagen 2)
2.- Quirúrgicos: Generalmente la cirugía se reserva para las caderas con mayor grado de afección y pacientes mayores de 6 años, en los cuales es necesario realizar un manejo adecuado de las secuelas. Los dos procedimientos más comúnmente utilizados son (30):
a) Osteotomía femoral proximal:
- La osteotomía varizante de la porción proximal del fémur centra la cabeza femoral en la profundidad del acetábulo mientras mantiene el miembro alineado en posición de carga. Los prerrequisitos necesarios para realizar la osteotomía son la completa movilidad articular, buena congruencia articular, y la comprobación de la correcta cobertura en abducción y rotación interna para lo cual puede ser de utilidad la artrografía (32).
- Se recomienda llevar el ángulo cervico-diafisiario con la cirugía a 110-120°, ya que parte del varo remodela. Si se considera necesario se puede agregar desrotación o extensión al momento de realizar la osteotomía varizante.
- Las ventajas de este procedimiento son: Se opera el hueso afecto, se acelera el proceso de cicatrización al aumentar la velocidad de revascularización local. Las principales desventajas al procedimiento son: Varo excesivo, falta de remodelación del varo, acortamiento de la extremidad, debilidad de los abductores, sobrecrecimiento del trocánter mayor, necesidad de retirar el implante metálico y el riesgo de fractura al realizar este procedimiento. Sumado a lo anterior, este método no se recomienda en mayores de 8 años, dada la limitada remodelación en niños de este grupo etario (30).
b) Osteotomía de Salter:
- La osteotomía innominada de Salter, es otra forma muy frecuente de mejorar la cobertura acetabular, ya que lo redirige hacia anterior y lateral(34). Esta consiste en efectuar un corte horizontal del iliaco, para reorientar el fragmento distal de la hemipelvis, trasladando el cótilo hacia abajo (aducción) y delante(extensión), usando como pivote de rotación a la sínfisis púbica. El efecto que se obtiene es cubrir la cabeza femoral por arriba, por lateral (aproximadamente 15°) y por anterior (aproximadamente (25°)(35)
- Las condiciones para su realización son muy similares a las de la osteotomía proximal femoral, ya que se deben realizar estudios previos que permitan centrar a la cabeza femoral en el acetábulo, corregirse todas las contracturas musculares y restaurarse la movilidad de la cadera. (34)
- Si bien no hay consenso absoluto sobre las desventajas de esta cirugía, algunos autores destacan que al sufrir el cótilo un desplazamiento distal, se incrementa la tensión de los músculos periarticulares por estiramiento de sus fibras, (se ha calculado un 4% para el psoas y un 6% para el glúteo medio) lo que lleva a un aumento de solicitaciones articulares y al alargamiento de la extremidad operada. Otros autores aducen que la corrección del índice acetabular es muy escasa ya que sólo se obtienen más o menos 10° y el ángulo de Wiberg sólo 19° en promedio (35)
En algunos casos la combinación de ambas osteotomías puede ser necesaria para lograr una mayor cobertura de la cabeza femoral, esto generalmente en pacientes mayores de 9 años, con subluxación lateral de la cabeza femoral(30).
c) Otros procedimientos:
- Artroplastía tipo Shelf: Aunque formalmente está descrita como método de tratamiento de "salvamento" en los casos incongruentes, recientemente se realiza de forma primaria en niños mayores de 8 años Catterall III-IV. Este procedimiento permite recubrir la porción más anterolateral de la cabeza femoral previniendo la subluxación o el crecimiento lateral de la epífisis. Otras indicaciones son la subluxación lateral de la cabeza, inadecuada cobertura o la cadera en "bisagra" asociada a las formas severas
- Osteotomía de Chiari: Mejora la cobertura lateral de la cabeza deformada y/o aplastada, pero no reduce el rozamiento lateral a la abducción y puede incrementar la insuficiencia glútea.
- Queilectomía: Procedimiento utilizado en el pasado y que consiste en remover fragmentos de la cabeza femoral que protruyen en la porción anterolateral, con la idea de mejorar la movilidad y evitar el fenómeno de abducción en bisagra.
Complicaciones.
- Artrosis por lesión del cartílago.
- Osteocondritis disecante: Es una rara complicación que afecta al 3% de los pacientes con enfermedad de Perthes, generalmente en casos de gran afectación (Catterall III-IV) o edad avanzada en los que los mecanismos de reparación o reosificación son insuficientes. Pueden ocasionar dolor intermitente pudiendo requerir diversos métodos de tratamiento sintomático, a base de AINEs y descarga de la extremidad con vista a favorecer la curación o reincorporación del fragmento. Si el dolor es persistente, se puede intentar promover la vascularización del fragmento osteocondral por medio de perforaciones a través del cuello femoral y fijación interna por medio agujas o tornillos canulados tipo Herbert. Si el fragmento se han desprendido de su lecho y no puede ser repuesto se recomienda su extirpación.
- Falta de crecimiento del cuello femoral, posiblemente por fusión prematura parcial o total de la epífisis.
Pronostico a Largo Plazo
En la mayoría de los casos el pronóstico es bueno y con secuelas variables de acuerdo a cada individuo. Otros, afortunadamente los menos, desarrollarán artritis degenerativa tardía en el adulto de mediana edad.
El pronóstico de la repercusión anatómica depende fundamentalmente de la edad de inicio de la enfermedad, de la magnitud de la necrosis y la superficie comprometida de la cabeza femoral, la persistencia de subluxación lateral de ésta, además del tratamiento oportuno. De esta manera, la enfermedad puede curar sin secuelas, con mínimas secuelas o dejar una deformidad, con aumento de tamaño y ensanchamiento de la cabeza femoral (coxa magna, coxa plana), que puede a su vez conducir a una artrosis temprana de cadera.
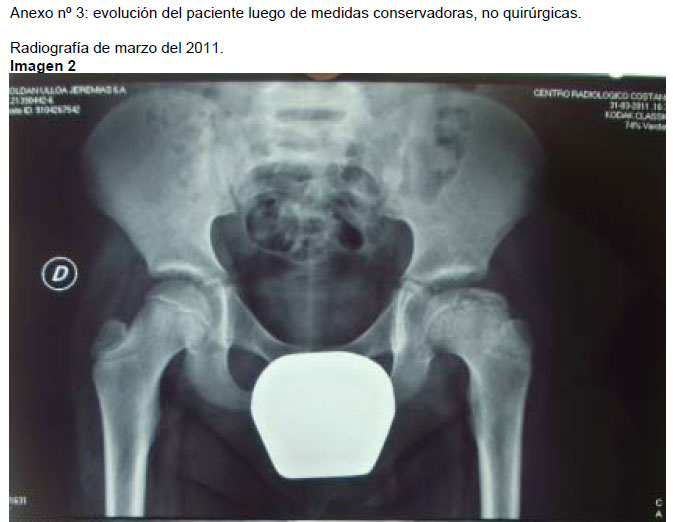
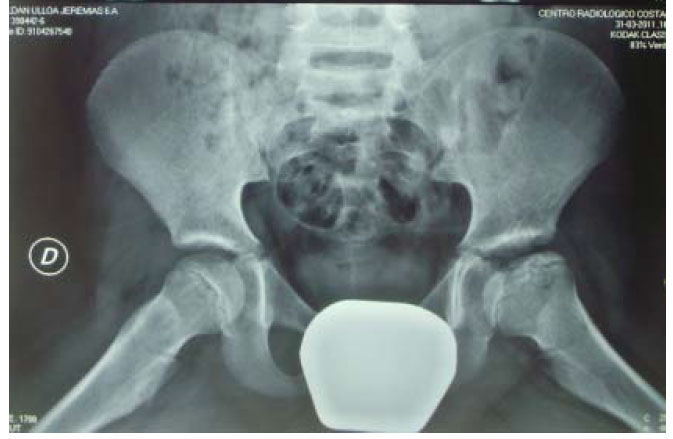
(ver anexo 3:” evolución a un año de tratamiento”)
Factores pronóstico
A. Clínicos:
1. Edad en el momento del diagnóstico: Es el factor pronóstico más universalmente aceptado. La mayoría de los ortopedas han observado que la recuperación es mucho mejor cuando la enfermedad afecta a menores de 5-6 años(32). Una posible explicación de esto podría ser que en estos niños más pequeños existirían más tiempo disponible para la remodelación de cualquier deformidad de la cabeza femoral. Además, se ha comprobado que la remodelación acetabular ocurre en los 8 primeros años de vida.
2. Pérdida persistente de la movilidad articular: En las fases precoces la pérdida de la movilidad es atribuible a la contractura de las partes blandas; pero avanzada la enfermedad lo que traduce es deformidad de la cabeza articular.
3. Obesidad: El sobrepeso deformará con mayor facilidad el área reblandecida de la cabeza femoral. Además las férulas de descarga de la articulación se adaptan mal en niños más gorditos.
B. Radiológicos:
1. Signo de Gage: defecto de osificación de la porción lateral de la epífisis.
2. Calcificación lateral epifisaria.
3. Extrusión o subluxación de la cabeza.
4. Rarefacción metafisaria difusa.
5. Horizontalización de la fisis.
6. Grado de extensión: Catterall III-IV, Salter & Thompson B, o grupo C del pilar externo de Herring.
La deformidad residual de la cabeza femoral determina el pronóstico y esto va a depender de la edad de aparición, grado de afectación de la epífisis, contención de la cabeza femoral, arco de movilidad articular, cierre prematuro de la epífisis y tipo de tratamiento. A largo plazo se pretende evitar el desarrollo de artritis degenerativa tardía, la cual posee una incidencia de prácticamente un 100% cuando la ELCP aparece con más de 10 años de edad, del 38% cuando comienza entre los 6 y 9 años de edad y un riesgo mínimo en niños de 5 años o menos de edad, ya que son más activos los procesos regeneradores(31).
Finalmente podemos decir que el pronóstico de la ELCP es bastante favorable y los resultados son satisfactorios en el 57 a 65% de los casos(31), incluso con tratamientos muy dispares, o en ciertos casos sin tratamiento. La mayor parte de los enfermos se encuentra bien después de ser adultos de mediana edad, pero la mitad de los casos graves exigirán alguna técnica de prótesis articular.
Anexos
Referencias
- Dezateux C, Roposch A. The puzzles of Perthes’ disease. The Journal of bone and Joint Surgery 2005; 1463-1464
- McKee J: Outcomes still modest a century after Perthes discovery. Clinical News and Views 2010; 4-12.
- Orban B, Adam R: Legg-Calvé-Perthes disease (Hip osteonecrosis). A Journal of Clinical Medicine,Vol 2 2007; 133-141.
- Nelitz M, Lippacher S, Krauspe R, Reichel H: “Perthes Disease, Current Principles of Diagnosis and Treatment” Deutsches Ärzteblatt International. Dtsch Arztebl Int 2009; 106(31–32): 517–23.
- Kliegman R, Behrman R, Jenson H, Stanton B: “Nelson tratado pediátrico”. Edición nº 18 volumen II 2009; 2806-2808.
- Wiig O, Terjense T, Suenninsen S, Lie SA: The epidemiology and a etiology of Perthes’ disease in Norway. A nation Wide study of 425 patients. J Bone Joint Surg Br 2006; 88B: 1217-23.
- Kamegaya M, Saisu T, Ochiai N, Hisamitsu J, Moriya H: A paired study of Perthes’ disease comparing conservative and surgical treatment. The Journal of bone and joint Surgery 2004; 1176-1181
- Loder RT, Schwartz EM, Hensinger RN: Behavioral characteristics of children with Legg-Calvé-Perthes disease. J Pediatr Orthop 1993; 13: 598–601.
- Atsumi T, Yamano K, Muraki M, Yoshihara S, Kajihara T: The blood supply of the lateral epiphyseal arteries in Perthes' disease: J Bone Joint Surg Br 2000; 82: 392–8.
- Kristmundsdottir F, Burwell RG, Harrison MH: Delayed skeletal maturation in Perthes' disease. Acta Orthop Scand 1987; 58: 277–9.
- Westhoff B, Krauspe R, Kalke AE, Hermsen D, Kowall B, Willers R, Schneider U: Urinary excretion of deoxypyridinoline in Perthes' disease: a prospective, controlled comparative study in 83 children. J Bone Joint Surg Br 2006; 88: 967–71.
- Catterall A: The natural history of Perthes‘ disease. J Bone Joint Surg 1971; 53B: 37.
- Sundt H: Malum coxae Calvé-Legg-Perthes. Acta Chir Scand 1949; 148: 1.
- Stulberg SD, Cooperman DR, Wallensten R: The natural history of Legg-Calvé-Perthes’ disease. J Bone Joint Surg Am 1981; 63: 1095.
- Mose K: Methods of measuring in Legg-Calvé-Perthes’ disease with special regard to the prognosis. Clin Orthop 1980; 150: 103.
- Phemister DB: Operation for epiphysitis of the head of the femur (Perthes´ disease). Findings and results. Arch Surg 1921; 2: 221.
- Zemansky AO: The pathology and pathogenesis of Legg-Calvé- Perthes disease (osteocondritis juvenilis deformans coxae). Am J Surg 1928; 4: 169.
- Waldenström H: On coxa plana. Acta Chir Scand 1923; 55: 577.
- Waldenström H: The first stage of coxa plana. Acta Orthop Scand 1934; 4: 1.
- Jonsäter S: Coxa plana. A histo-pathologic and arthrographic study. Acta Orthop Scand 1953; 12.
- Catterall A, Pringle J, Byers PD: A review of the morphology of Perthes’ disease. J Bone Joint Surg Br 1982; 64: 269.
- Salter RB: Experimental and clinical aspect of Perthes’ disease. J Bone Joint Surg 1966; 48B: 393.
- Bowen JR, Foster BK, Hartzel CR: Legg-Calvé-Perthes disease. Clin Orthop 1984; 185: 97.
- Krauspe R, Raab P: Morbus Perthes. Orthopäde 1997; 26: 289–302.
- Eggl H, Drekonja T, Kaiser B, Dorn U: Ultrasonography in the diagnosis of transient synovitis of the hip and Legg-Calvé-Perthes disease. J Pediatr Orthop B 1999; 8(3): 177–80.
- Lobert PF, Dillman JR, Strouse PJ, Hernandez RJ: Unexpected MRI findings in clinically suspected Legg-Calvé-Perthes disease. Pediatr Radiol 2010.
- Herring J, Kim HT, Browne R: Legg-Calvé-Perthes Disease, part I: Classification of radiographs with use od the modified lateral pillar and stulberg classifications. The journal of bone and joint surgery · JBJS.org volumne86-A · number 10 · october 2004.
- Pietrzak S, Napiontek M, Tomaszewski M: Catterall and Herring classifications in assessing Perthes disease - inter- and intra-observer study. Klinika Ortopedii CMKP, Otwock.Ortop Traumatol Rehabil2004 Oct 30;6(5):561-6.
- Specchiulli F, Scialpi L: Catterall versus Herring classification in Perthes' disease. I Clinica Ortopedica, Università, Bari1997 Jul-Sep;82(3):289-93.
- Martínez A: Enfermedad de Legg-Calve-Perthes, Conceptos actuales. Revista Mexicana de ortopedia pediatrica Vol. 5, Núm. 1 Enero-Diciembre 2003; 5-11.
- López J:Enfermedad de Legg-Calvé-Perthes. Servicio Andaluz de Salud. CS Nueva Andalucía.
- González-Herranz P, De la Fuente-González C, Castro-Torre M. ENFERMEDAD DE PERTHES. Sección de Cirugía Ortopédica y Traumatología Infantil Hospital Materno-Infantil Teresa Herrera.
- De la Torre Rojas M, Torres C, Menéndez E: Elementos de actualización sobre la enfermedad de Legg-Calvè-Perthes. Revista Cubana de Ortopedia y Traumatología 1999.
- Frias Austrias R. Enfermedad de Legg- Calve- Perthes: Acta ortopédica mexcana Mayo-Junio 2009; 172-181. Hospital Ángeles del Pedregal.
- Fernandez Fairen M, Ballester Soleda J: Osteotomías pélvicas. Ortho-tips Vol. 1, Num. 1 Julio- Septiembre 2005.
- Meave J, De la Torre D, Góngora J, Salazar R, González F: Recuperación funcional de pacientes con Legg Calvé Perthes, posterior a tratamiento. Revista Hospital Juárez de Mexico 2005; 72(3):112-116.
|

