Introducción
Las Enfermedades Inflamatorias Intestinales (EII), son patologías crónicas caracterizadas por una reacción inflamatoria de la mucosa intestinal. Entre ellas se incluye la Enfermedad de Crohn (EC), la Colitis Ulcerosa (CU), y la Colitis Indeterminada (CI). Se estima que en Estados Unidos la incidencia de esta patología va desde los 2,2 a los 14,3 casos por 100.000 habitantes en población adulta (1). En Chile y el mundo se ha observado un aumento de estas patologías durante los últimos 10 años (2) y en 25% de ellas, se presentan durante la infancia (3).
Este grupo de patologías crónicas causan complicaciones a nivel intestinal como son los abscesos, las fístulas y las estenosis gastrointestinales de la Enfermedad de Crohn que pueden incluso llegar a una obstrucción intestinal; también se clasifican dentro de este grupo, el megacolon tóxico, la perforación intestinal y la hemorragia masiva que son más frecuentes en los pacientes con CU, todas complicaciones que pueden llegar a comprometer la vida. Dentro de las complicaciones extraintestinales, las más habituales y que incluso pueden ser la única manifestación de la enfermedad, son: talla baja, fracturas patológicas por osteoporosis, anemia y cáncer. Es de gran importancia reconocer estas patologías asociadas ya que su aparición determina la severidad del cuadro clínico y la complejidad y oportunidad del tratamiento médico-quirúrgico (4).
El objetivo de esta revisión es describir las complicaciones intestinales y extraintestinales de las Enfermedades Inflamatorias Intestinales, en la población pediátrica.
Criterio de búsqueda y selección
Buscamos en PubMed, usando “medical subject heading” (MeSH) utilizando los términos “inflammatory bowel disease”, “ulcerative colitis”, “Crohn's disease”, “complications”, “strictures”, “anemia”.
Complicaciones intestinales
Se denominan con este nombre todas las patologías derivadas de la reacción inflamatoria propia de las EII, dentro del intestino, y que comprometan desde la pared muscular hasta la mucosa. Se ha observado cierta especificidad de las manifestaciones intestinales, si se trata de CU o EC, por ejemplo, la presencia de fístulas y abscesos orientan el diagnóstico a EC, en cambio, el megacolon tóxico nos hará pensar en CU. Pero también hay manifestaciones en común como la hemorragia masiva, y la estenosis intestinal (4). (Tabla 1)
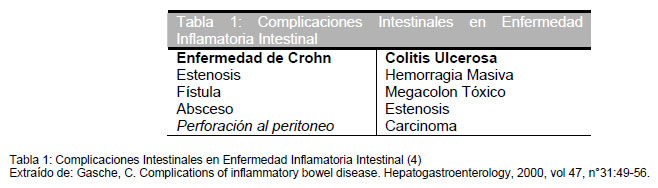
Enfermedad de Crohn (EC)
Estenosis y Obstrucción Intestinal
La complicación más frecuente de la EC es la estenosis gastrointestinal. E sta es causada por una desregulación de la cicatrización, que se caracteriza por provocar una formación, reorganización y/o actividad contráctil excesiva del colágeno, produciendo fibrosis de la mucosa que progresa finalmente a la estenosis. Hay múltiples clasificaciones de esta complicación pero la más aceptada es aquella que la divide en estenosis inflamatoria y estenosis fibrótica, atendiendo a la fisiopatología de cada una. Las primeras se establecen durante el brote de la enfermedad siendo causadas tanto por la inflamación como por el edema de la mucosa y se asocian a predictores de actividad de la enfermedad (VHS y PCR aumentadas, fiebre y leucocitosis, entre otras). La segunda es producto de cambios fibróticos crónicos, lo que trae consecuencias en la respuesta al tratamiento y pronóstico de la enfermedad. Esta clasificación es una simplificación extrema del problema y podrían llegar a coexistir ambos tipos en un mismo paciente. La importancia de esta complicación radica en que la obstrucción intestinal , hace imperativa la resolución quirúrgica de la misma (5) . El diagnóstico diferencial debe hacerse con edema de la mucosa sin estenosis, que también es causa de obstrucción intestinal en estos pacientes (6). El diagnóstico se basa en la clínica de obstrucción intestinal (dolor cólico, distensión abdominal, vómitos y empeoramiento de los síntomas tras la ingesta alimentaria) y en los estudios imagenólogicos. Los de mayor utilidad son los exámenes contrastados con bario, como la radiografía esófago-estómago-duodeno y el enema baritado (7). La elección depende de la localización de la estenosis, observándose claramente el sitio afectado. El tratamiento de la estenosis puede ser médico o quirúrgico, pero la postura actual se inclina hacia la cirugía. El tratamiento con esteroides endovenosos podría beneficiar a los pacientes con estenosis de tipo inflamatorio pero no a las de tipo fibróticas que mejoran con la cirugía (6). Otros autores rechazan el tratamiento médico, por considerarlo inefectivo (4,6,8,9), y recomiendan siempre tratamiento quirúrgico. Evaluando la magnitud de esta complicación se ha observado que un 50% de la población pediátrica requiere de una resección intestinal antes de que transcurran 5 años desde que fue hecho el diagnóstico de EC a causa de la estenosis (10). Las opciones quirúrgicas son: resección quirúrgica, estenoplastía y dilatación endoscópica con balón.
Abscesos, Fístulas y Sepsis
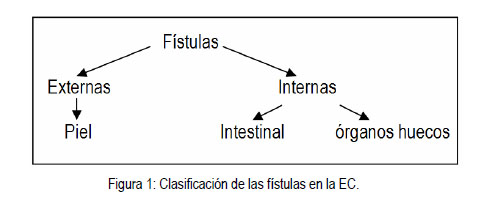 |
Los abscesos y fístulas son complicaciones comunes en la EC y se consideran dentro de una misma historia natural. Más de un 25% de los pacientes con EC que van a cirugía, tienen una masa o absceso abdominal, y de éstos, un 40% tendrá una fístula asociada (11). La fístula es una comunicación anormal entre dos epitelios que se encuentra rodeado por tejido de granulación. Se clasifican en dos tipos, las fístulas externas que son las que comunican intestino con la piel y las fístulas internas, quienes a su vez se dividen en dos subgrupos, las que comunican dos asas intestinales y las que comunican el intestino con algún órgano hueco (Figura 1) . Se estima que la incidencia de esta manifestación en los pacientes con EC, va de 17 a 50% (12), y en ocasiones precede por años a las manifestaciones propias de la enfermedad. Los abscesos de la pared abdominal, tal como los abscesos del iliopsoas y el recto con o sin una fístula concomitante, son complicaciones poco comunes en EC, con una incidencia de 0,4-4%. Sin embargo, en el paciente postoperatorio, las fístulas pueden ocurrir en un 21% de los casos. En cuanto a la patogénesis, se acepta que las fístulas internas pueden ser secundarias a una obstrucción intestinal por el aumento de presión intraluminal o abscesos que se rompen a vísceras adyacentes; las fístulas perianales o externas no se originan en el intestino delgado, sino que se convierten localmente a úlceras penetrantes profundas en el ano o el recto o pueden ser secundarias a un absceso de glándulas anales (12). Más de un tercio de las fístulas enterocutáneas del intestino delgado son secundarias a EC, pero la proporción es mayor si se incluyen las fístulas postoperatorias. Es importante diagnosticarlas ya que se complican con infecciones bacterianas. El diagnóstico de certeza se realiza bajo anestesia general con la exploración digital directa de la fístula y la introducción de sondas por el trayecto fistuloso. Actualmente, se utilizan también los fístulogramas y la tomografía computada de pelvis (13). En estos casos está indicado el drenaje quirúrgico y la antibioticoterapia con ciprofloxacino y metronidazol por sí solos o en combinación como tratamiento de primera línea (14). Present (12) recomienda temprano uso de 6MP/azatioprina como tratamiento de segunda línea en estos pacientes y cree que es un error administrar infliximab antes de tratar con este esquema ya que han sido probados como efectivos y tienen menos efectos adversos de tipo alérgico. Sin embargo, otros autores (15) afirman que infliximab es el tratamiento de elección porque se ha observado una tasa de cicatrización de la fístula de 55% en 3 meses con este fármaco, aunque éste no dura mucho tiempo. El uso de inmunosupresores simultáneamente con infliximab disminuye la respuesta de este último. Si falla la terapia con 6MP/azatioprina se puede administrar infliximab 5 mg/kg a las 0, 2 y 6 para inducción y luego cada 8 semanas (14). Una alternativa a infliximab es adalimumab que se da vía subcutánea (S.C.) en 160 mg en la semana 0, 80 mg a la semana 2, y luego 40 por cada semana, empezando en la semana 4. La ciclosporina A es una alternativa plausible en pacientes alérgicos o que no responden a infliximab. El drenaje radiológico o quirúrgico de un absceso secundario a EC puede ser una medida efectiva para disminuir el riesgo de sepsis intraabdominal, pero la resección definitiva del segmento de intestino afectado con drenaje simultaneo será requerido en la mayoría de los pacientes (15, 16 ). La resección laparoscópica es útil, pero la laparatomía es la cirugía mas apropiada para el manejo de la enfermedad fistulosa compleja (15). La prevención de las fístulas intestinales puede llevarse a cabo mediante estenoplastía temprana o la resección de estenosis subyacentes, según algunos autores (4). La presencia de una fístula entero-enteral en un paciente asintomático visible con radiografía contrastada, no merece ningún tratamiento quirúrgico (14).
Colitis Ulcerosa (CU)
Hemorragia Masiva
Mientras que el sangrado mediano es una manifestación común del las EII, la Hemorragia Masiva es un fenómeno raro que ocurre en un 2-3% de los casos y representa un 10% de las colectomías de urgencia por CU. Aunque este cuadro puede ocurrir a cualquier edad es más frecuente en los pacientes jóvenes. La cantidad de sangrado se correlaciona con la extensión (mayoría son pancolitis) y severidad de la enfermedad. La hemorragia se debe a una ulceración mucosa difusa que afecta al intestino. El estudio diagnóstico puede incluir ileocolonoscopía, aunque la mayoría de las veces no da información, ni se ha demostrado que la endoscopía sirva para detener el sangrado. Se ha reportado que cerca de un 30% de pacientes con EC tenían una úlcera sangrante localizada como origen de la hemorragia. También con una angiografía mesentérica es posible localizar el sangrado. En cuanto a la cirugía, la mejor opción para CU es la colectomía subtotal con ileostomía, ya que la proctocolectomía total con ileostomía aumenta la morbilidad y puede comprometer la indemnidad del esfínter anal. La hemorragia masiva que amenace la vida, es indicación de proctocolectomía inmediata (11).
Colitis Fulminante, Megacolon Tóxico y Perforación.
La Colitis Fulminante y Megacolon Tóxico, son parte de un espectro de manifestaciones de la CU. La colitis fulminante se manifiesta por más de 10 deposiciones sanguinolentas al día, anorexia, taquicardia, fiebre, sangrado continuo, anemia que requiere transfusión sanguínea y sensibilidad abdominal. Aunque no existe una definición formal, esta denominación identifica pacientes que tienen CU severa complicada con fiebre alta, sangrado, marcadores séricos de inflamación muy elevados, o pérdida de peso (17). Algunos pacientes pueden desarrollar Megacolon Tóxico (MT) como estadio final de una colitis fulminante. Esta una emergencia quirúrgica asociada con riesgo de perforación, sepsis, alteraciones electrolíticas y hemorragia (18). El MT se define como la dilatación, no obstructiva, total o parcial del colon, mayor o igual a 6 cm , asociado a toxicidad sistémica. La incidencia no ha sido estudiada sistemáticamente, pero hace algunos años se estimaba en un 8-15% en adultos, en un centro de referencia de EII. En niños se describe como una complicación rara (18,19). El diagnóstico temprano, el manejo médico más intenso y la cirugía temprana han reducido la incidencia de esta complicación. La patogenia aún no está del todo dilucidada pero se cree que mediadores químicos como el óxido nítrico pueden jugar un rol importante. La inflamación aguda de la mucosa se expande a toda la pared, asociada con una pérdida del tono muscular de la capa muscular lisa, que finalmente permite la dilatación del colon. El óxido nítrico inhibe el tono muscular. La cantidad y actividad de la sintasa de oxido nítrico inducible está significativamente aumentada en los pacientes con megacolon tóxico. La posibilidad de desarrollar esta complicación se ve aumentada por cualquier factor que afecte la motilidad colónica, como: hipokalemia, hipomagnesemia, medicamentos anticolinérgicos o antidiarreicos (19). El megacolon tóxico debe ser sospechado frente a un paciente con una semana o más de evolución de colitis severa y que se encuentra con toxicidad clínica según los siguientes parámetros: fiebre > 38,6°C, taquicardia > 100 latidos/minuto, leucocitosis > 10500/L e hipoalbuminemia < 3 gr/dL. También pueden estar alterados otros parámetros en respuesta a la inflamación sistémica como la velocidad horaria de sedimentación (VHS), la proteína-C reactiva y pueden existir alteraciones electrolíticas como hipokalemia e hipomagnesemia que exacerban el cuadro. El diagnóstico se confirma con una radiografía simple de abdomen, en la que se observará la dilatación colónica. Ante el hallazgo de islas mucosas (remanentes edematosos de la mucosa que se proyectan al lumen) o de un íleo asociado con 3 o más asas intestinales, la indicación quirúrgica es inmediata en colitis severa, independientes de si exista o no dilatación (11,19). La tomografía computada es más sensible en la detección de perforación localizada, aunque no para observar la dilatación colónica. El manejo debe incluir tratamiento médico agresivo y una decisión quirúrgica temprana. Se deben corregir las alteraciones de fluidos y electrolitos y aportar trasfusiones de sangre si es necesario. Los antibióticos de amplio espectro son útiles para disminuir el riesgo de traslocación bacteriana ya que la barrera intestinal se encuentra vulnerada por la inflamación. El éxito del tratamiento se basa en la monitorización continuada de los signos vitales, hidratación, medición de la circunferencia abdominal y radiografías de abdomen, lo que debe ser suplementado con las pruebas de laboratorio y el examen abdominal seriado (11). La administración de hidrocortisona endovenosa (e.v.) (100 mg. c/6 hrs.) debe comenzar de inmediato junto con fluídos, electrolitos y antibióticos (metronidazol 500 mg. c/8 hrs. y ciprofloxacino 500mg c/12 hrs.). Los opiodes y anticolinérgicos deben suspenderse y se debe comenzar profilaxis de eventos trombóticos con heparina s.c. La cirugía esta indicada en los pacientes con perforación, peritonitis, hemorragia masiva, si no hay mejoría en 48-72 de tratamiento médico agresivo y la persistencia de la dilatación en la radiografía de abdomen. Las opciones quirúrgicas son colectomía subtotal o proctocolectomía ambas con ileostomía, no se recomienda una restitución inmediata del tránsito por el riesgo de infecciones. (11). La Perforación franca es más común en CU que en EC y esta usualmente asociada a megacolon tóxico y CU severa (11,18). La incidencia de esta complicación va desde el 2% (11) al 20%, en pacientes con CU, pero todos ellos coinciden en la asociación con megacolon tóxico y colitis fulminante (19), también se ha visto asociada a obstrucción intestinal en EC, a adenocarcinoma, a perforación endocópica o falla de una anastomosis. El diagnóstico puede retrasarse ya que las grandes cantidades de esteroides que reciben estos pacientes, pueden enmascarar los síntomas de peritonitis. La clínica se manifiesta por dolor abdominal o de hombro asociado a fiebre y taquicardia. Siempre debe existir un alto grado de sospecha de esta complicación en un paciente con colitis fulminante. Una vez que se sospecha el cuadro el paciente debe ser preparado para la cirugía, por lo que se debe solicitar pruebas de laboratorio: hemograma, electrolitos, que las máticos estudio de coagulación y grupo sanguíneo. La radiografía de abdomen enseñará dilatación del colon y aire libre en el peritoneo en un 20% de los casos. Se debe estabilizar al paciente con fluídos, antibióticos de amplio espectro y esteroides de estrés si ha usado esteroides previo al ingreso. La única opción terapéutica es la cirugía, y la técnica de elección en CU es la colectomía subtotal con ileostomía, y una reconstitución del tránsito posteriormente. (11)
Displasia y Cáncer (véase complicaciones extraintestinales)
Estenosis colónica
Por décadas las estenosis fueron relacionadas tan sólo con EC, y relativamente no reconocidas en CU. Pero se ha reportado asociación entre CU con estenosis colónica y displasia e incluso cáncer, en 5% de los pacientes. La vigilancia endoscópica de estas lesiones no ha demostrado prevenir el adenocarcinoma avanzado. Por esta razón estos pacientes debieran ser considerados para la cirugía oportuna.
Complicaciones Extraintestinales
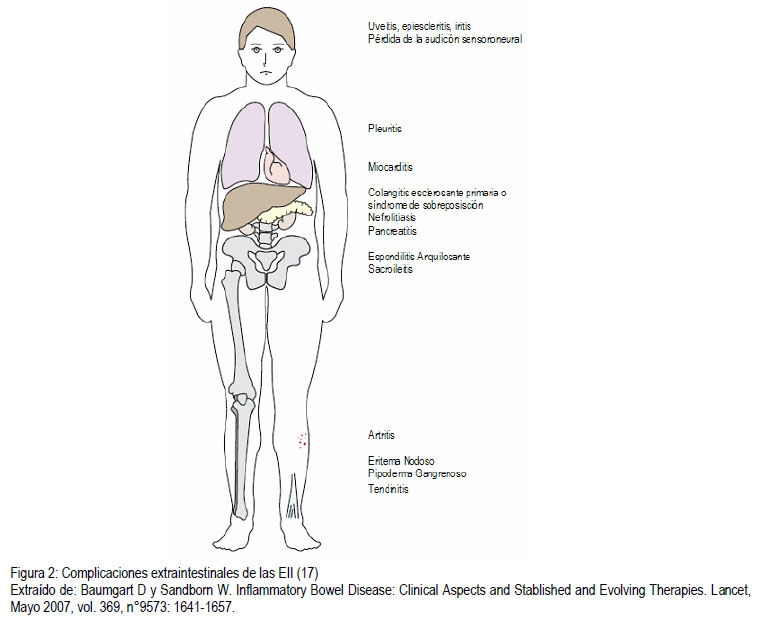
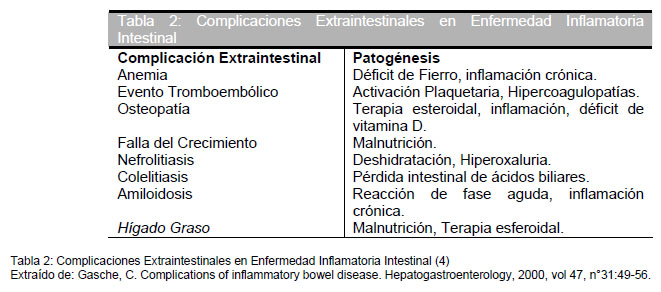
Más de un 25% del los pacientes con EII desarrollarán manifestaciones o complicaciones extraintestinales (Figura 2) (17,20,21). En la Tabla 2 se observan las manifestaciones más frecuentes y su patogenia. En esta revisión nos enfocaremos a las complicaciones extraintestinales de las EII en la edad pediátrica como lo son la falla de crecimiento, el retraso puberal, la anemia, la osteoporosis y el cáncer.
Falla del crecimiento
La Falla de Crecimiento se caracteriza por un retraso de la maduración esquelética y Retraso Puberal (3,18,22-24), que puede preceder el desarrollo de los síntomas intestinales y dominar la presentación de la enfermedad (25). Ha sido reconocida como una complicación de la EC desde las descripciones más tempranas de esta enfermedad. La adolescencia es el momento en que con mayor frecuencia se hace el diagnóstico, ya que es en esta edad en que hay preocupación tanto por parte de los padres como del niño respecto de estatura de este último. La etiología no es clara, pero puede ser explicada por deficiencias nutricionales, como consecuencia del estado inflamatorio sistémico, alteraciones del eje de la hormona del crecimiento/factores de crecimiento insulino-símiles, el uso crónico de corticoides (26) y el sedentarismo (3,18). Factores clínicos que pudieran influir en la talla final de estos pacientes, incluirían: retraso en el diagnóstico, presencia de enfermedad yeyunal al diagnóstico, comienzo prepuberal de los síntomas, sexo y severidad de la enfermedad. Por otra parte, el antecedentes de talla baja familiar debe ser considerado, si está presente, como también la influencia de la terapia como corticoides y reseción intestinal (21,22). El manejo óptimo de la falla del crecimiento pasa por el manejo óptimo de la EII (3). La remisión de la EC , resulta en una mejora en el crecimiento y en la nutrición, permitiendo tener la expectativa de alcanzar una edad final adulta adecuada (promedio de la talla paterna ± 6,5 cm .). Se debe tener particular cuidado al proveer la terapia adecuada durante la etapa de crecimiento acelerado. Se han observado aumentos importantes en la velocidad de crecimiento, luego de la resección intestinal (3). El retraso del crecimiento y desarrollo puberal puede tener un impacto negativo en el desarrollo psicosocial y de autoimagen en los niños. La transición desde la adolescencia temprana a la tardía puede ser particularmente difícil en los niños con EII crónicamente activa (22).
Anemia
La Anemia es una complicación común e importante en EII. La prevalencia de anemia en pacientes con EC va desde 10,2% a 72,7% y desde 8,8% a 66,6% en pacientes con CU, y desde 17,5% a 73,7% en pacientes con Colitis Indiferenciada (27,28). La prevalencia varía con la edad (adultos o niños) y con la población de pacientes que se considere (ambulatorios u hospitalizados). Los mecanismos de producción de la anemia en las EII pueden ser: a) Deficiencia de fierro, resultante del sangrado intestinal debido a la inflamación y ulceración, b) Anemia de las enfermedades crónicas, resultante de la inhibición o supresión de la eritropoyesis y alteración del transporte de fierro mediado por citoquinas inflamatorias, el diagnóstico diferencial debe aclararse con un estudio de cinética de fierro, aunque a veces estos dos mecanismos se mezclan. Son poco frecuentes la deficiencia de vitamina B12 y folatos y la anemia hemolítica como mecanismos causa (4). La corrección de la anemia trae importantes beneficios en la calidad de vida de los pacientes con EII. La anemia no es un diagnóstico pero es un signo objetivo de enfermedad. La corrección de la anemia no es posible si no se conoce la causa de la misma (28). El tratamiento de la deficiencia de fierro es la suplementación con fierro. Muchos pacientes con EII, no toleran las preparaciones de fierro, por lo que debe considerarse la administración endovenosa de fierro que es efectiva y segura. Las dificultades se presentan en pacientes con inflamación activa, ya que la respuesta al tratamiento será subóptima. La administración de eritropoyetina ha demostrado beneficios en aquellos pacientes resistentes al tratamiento con fierro, pero no esta exenta de riesgos, y es costoso.
Osteopenia y Osteoporosis
Pacientes con EII están en mayor riesgo de tener una baja densidad mineral ósea definida como Osteopenia u Osteoporosis , especialmente aquellos con EC. Se ha comprobado que cerca de un 13-42% de los pacientes con EC tiene baja densidad mineral ósea (29). La Osteoporosis predispone a las fracturas. Niños con EC tienen una menor densidad ósea que los controles normales y que niños que padecen CU. La masa ósea total se acumula rápidamente a través de la pubertad y la adolescencia, alcanzando su peak a los 35 años. Una interrupción de este proceso crucial, inevitablemente llevará a una reducción del peak de masa ósea, con el consecuente aumento del riesgo de fracturas en etapas más avanzadas de la vida. La etiología de esta complicación es multifactorial e incluye: el uso crónico de esteroides (3,26), citoquinas circulantes (como la IL-6 ), absorción disminuida de calcio y vitamina D, edad, sexo, desnutrición, deficiencia de hormonas sexuales y estado inflamatorio crónico. Una exposición a corticoides significativa es un factor que aumenta el riesgo de fracturas en adultos y niños (3,23). Muchos pacientes con EII tienen una masa muscular disminuida secundaria a factores nutricionales, farmacoterapia (corticoides) y falta de actividad física, lo que puede contribuir a la reducción de la masa ósea secundaria a la reducción de la estimulación mecánica del esqueleto con cargas. La osteoporosis, los síndromes dolorosos osteoporóticos y fracturas en hueso patológico pueden aumentar la morbilidad en los pacientes y tener un impacto negativo en la calidad de vida de niños, adolescentes y adultos (3). El manejo adecuado de esta complicación es de vital importancia. La profilaxis se lleva a cabo administrando suplementos de c alcio y vitamina D, estimulando la actividad física regular y aconsejando al paciente que deje el tabaco y alcohol en exceso, si son consumidores. Se debe determinar la masa mineral ósea al momento del diagnóstico de EC, en pacientes con factores de riesgo o cuando la terapia con corticoides sea considerada. El tratamiento farmacológico de la osteoporosis se basa en los bifosfonatos. La biodisponibilidad oral de los bifosfonatos es baja en pacientes sin EII, y es aún menor en pacientes con síndrome de malabsorción. Sin embargo, la terapia oral con bifosfonatos ha demostrado ser efectiva si se administra durante las remisiones de la EC. La administración parenteral es también aconsejable. El ibandronate en dosis de 1 mg. cada 3 meses se asocia con un aumento de un 5,4% de la masa mineral ósea, y una disminución de los marcadores de recambio óseo, con un perfil de seguridad excelente, después de un año de tratamiento (30).
Cáncer
La CU fue el primer factor de riesgo reconocido para Cáncer Colorectal hace aproximadamente 80 años atrás (31). Los pacientes con CU, pero probablemente no los con EC, tienen mayor riesgo de morir por cáncer colorectal que la población general (32, 33). Se ha demostrado que los pacientes en quienes se detectó el cáncer por vigilancia tienen tasas de 5 años más de sobrevida que aquellos que fueron detectados incidentalmente o que comenzaron con síntomas. Los programas de vigilancia para detectar Displasia, son en estos momentos el cuidado estándar que se debe llevar en los pacientes con CU. La displasia se encuentra frecuentemente en mucosa plana aparentemente sana. Por esta razón es que se deben tomar biopsias al azar a través de todo el colon, con una frecuencia anual o bianual cuando se tienen mas de 8-10 años de pancolitis y más de 15 años de colitis del lado izquierdo. Se acepta que la demostración de displasia de alto grado o cáncer en las biopsias es indicación absoluta de colectomía, mientras que la displasia de bajo grado “debe incitar a considerar la colectomía”. Sin embargo si se observa displasia de bajo grado en una masa lesional, o ésta es multifocal también es indicación de colectomía (31). Se ha descrito la existencia de fármacos modificadores del riesgo en el cáncer colorectal, como son el ursodiol, los 5-aminosalicilatos y los folatos. Se ha postulado que la excreción alterada de los ácidos biliares, asociado a una proporción aumentada de ácidos biliares secundarios en contacto con el epitelio colónico, aumentan el riesgo de desarrollar cáncer en los pacientes con EII. La suplementación con ursodiol, por su mecanismo de cambiar la concentración colónica de ácidos biliares secundarios como el ácido deoxicólico, ha sido estudiado, con muy buenos resultados, como un agente protector del cáncer en EII. Los efectos anticancerosos de compuestos de 5-aminosalicilatos (5-ASA), como la mesalazina y la sulfasalazina, son controversiales. Hay evidencias en ciencia básicas que la mesalazina inhibe la proliferación e induce apoptosis en células cancerosas de colon. Los estudios en humanos no han demostrado este efecto. Existe evidencia para pensar que la suplementación con folatos disminuirían el riego de cáncer colorectal, pero la relación no está bien definida aún. (32,33).
El cáncer de intestino delgado en pacientes con EC es distinto al cáncer de intestino delgado de-novo que se dá en aquellos sin EII. El primero ocurre más temprano en la vida y está restringido a las áreas inflamadas del íleon. Pacientes que sólo tienen EC de intestino delgado sin compromiso colónico no tienen mayor riesgo de cáncer colorectal que la población general. Para los pacientes con colitis por EC, el riesgo es similar a los pacientes con CU si el área comprometida y el tiempo de evolución son similares. Las recomendaciones de screening y vigilancia son similares a aquellas observadas para CU (17).
En resumen:
Las EII presentan una variedad de complicaciones durante su evolución clínica, y en esta revisión se destacan aquellas que se presentan en la niñez y adolescencia. Las complicaciones intestinales son más bien enfermedad específica pero un subgrupo puede presentarse en ambas enfermedades en igual proporción. Las complicaciones extraintestinales son múltiples, y las hay, tanto, asociadas a otras enfermedades autoinmunes, como secundarias a la enfermedad.
Se debe educar respecto de estas complicaciones a los pacientes y padres ya que de ellos depende finalmente la prevención y el éxito del tratamiento.
Es necesario hacer una pesquisa precoz de estas complicaciones como se lleva a cabo, por ejemplo en la displasia y cáncer colorectal, que por ser asintomático, requiere de un screening sistemático.
El diagnosticar estas patologías depende directamente de la experiencia del clínico y del grado de sospecha que éste posea al enfrentarse a este tipo de pacientes. Esto es de gran relevancia ya que el tratamiento oportuno es crucial, y depende totalmente del diagnóstico médico.
Debemos recordar que las complicaciones no son menores y que provocan un impacto negativo en la calidad de vida del paciente pediátrico y adolescente.
Bibliografía
- Figueroa C, Quera R, Valenzuela J, Jensen C. Enfermedades Inflamatorias Intestinales: Experiencia de Dos Centros Chilenos. Revista Médica de Chile 2005, vol. 133: 1295-1304.
- IBD Working Group of the European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN). Inflammatory Bowel Disease in Children and Adolescents: Recommendations for Diagnosis—The Porto Criteria. Journal of Pediatric Gastroenterology and Nutrition Julio 2005, vol. 41:1–7.
- Beattie R, Croft N, Fell J, Afzal N y Heuschkel R. Inflammatory Bowel Disease. Archives of Disease in Childhood 2006, vol.91:426–432.
- Gasche, C. Complications of Inflammatory Bowel Disease. Hepatogastroenterology, 2000, vol. 47, n°31:49-56.
- Gisbert JP et al. Tratamiento de la enfermedad de Crohn Estenosante. Gastroenterol Hepatol 2002, vol. 25, n°9:560-569.
- Froehlich F. Obstructive Fibrostenotic Crohn's Disease. Digestion 2005, vol. 71:29–30.
- (7) Ambrosini R, et al. Inflammatory chronic disease of the colon: How to image. European Journal of Radiology 2007, vol. 61: 442–448.
- Erkelens G y Van Deventer S. Endoscopic treatment of strictures in Crohn's disease. Best Practice & Research Clinical Gastroenterology 2004, vol. 18, n° 1: 201–207.
- Hommes D y Van Deventer S. Endoscopy in Inflammatory Bowel Diseases. Gastroenterology 2004, vol. 126:1561–1573.
- Federici di Abriola G, et al. Strictureplasty: An Alternative Approach in Long Segment Bowel Stenosis Crohn's Disease. Journal of Pediatric Surgery 2003, vol. 38: 814-818.
- Berg D, et al. Acute Surgical Emergencies in Inflammatory Bowel Disease. The American Journal of Surgery Julio 2002, vol.184, n°1: 45-51.
- Present D. Crohn's Fistula: Current Concepts in Management. Gastroenterology Mayo 2003, vol. 124, n°6:1629–1635 pp.
- Maconi G, et al. Contrast Radiology, Computed Tomography and Ultrasonography in Detecting Internal Fistulas and Intra-Abdominal Abscesses in Crohn's Disease: A Prospective Comparative Study. American Journal of Gastroenterology 2003, vol.98: 1545–1555.
- Válek V, Kysela P, Vavríková M. Crohn's Disease at the Small Bowel Imaging by the Ultrasound-enteroclysis. European Journal of Radiology 2007, vol. 62: 153–159.
- Slade D y Scott N. Intestinal fistulas. Surgery (Oxford) Octubre 2005 , vol. 23, n° 10 : 365-368.
- Neufeld D et al. Abdominal Wall Abscesses in Patients With Crohn's Disease: Clinical Outcome. Journal of Gastrointestinal Surgery 2006, vol. 10, n° 3: 445-449.
- Baumgart D y Sandborn W. Inflammatory Bowel Disease: Clinical Aspects and Stablished and Evolving Therapies. Lancet, Mayo 2007, vol. 369, n°9573: 1641-1657.
- Diefenbach K y Breuer C. Pediatric inflammatory bowel disease. World Journal of Gastroenterology Mayo 2006, vol. 12, n°20: 3204-3212.
- Evans K y Travis S. Toxic dilatation of the colon. Medicine 2007, vol. 35, n°3: 168-170.
- (20) Bernstein Ch, et al. The Prevalence of Extraintestinal Diseases in Inflammatory Bowel Disease: A Population-Based Study. American Journal of Gastroenterology 2001, vol. 96: 1116 –1122.
- Grant A, Lalor P, Salmi M, Jalkanen S y Adams D. Homing of Mucosal Lymphocytes to the Liver in the Pathogenesi s of Hepatic Complications of Inflammatory Bowel
- Disease. The Lancet Enero 2002, vol. 359: 150-157.
- Sawczenko A, Ballinger A, Savage M y Sanderson I. Clinical Features Affecting Final Adult Height in Patients With Pediatric-Onset Crohn's Disease. Pediatrics 2006, vol.118, n°1: 124-129
- Jenkins, H. Inflammatory Bowel Disease. Archives of Disease in Childhood 2001, vol. 85: 435–437.
- Mamula P, et al. Inflammatory Bowel Disease in Children 5 Years of Age and Younger. American Journal of Gastroenterology 2002, vol. 97: 2005–2010.
- Griffiths A. Specificities of inflammatory bowel disease in childhood. Best Practice & Research Clinical Gastroenterology 2004, vol. 18, n° 3: 509–523.
- Navarro F y Hanauer S. Treatment of Inflammatory Bowel Disease: Safety and Tolerability Issues. The American Journal of Gastroenterology 2003, vol. 98, n° 12: S18-S23.
- Wilson A, Reyes E y Ofman J. Prevalence and Outcomes of Anemia in Inflammatory Bowel Disease: A Systematic Review of the Literature. The American Journal of Medicine Abril 2004, vol. 116, n° 7, supl. 1:44S–49S.
- Cronin C y Shanahan F. Anemia in Patients With Chronic Inflammatory Bowel Disease. American Journal of Gatroenterology 2001, vol. 96, n° 8: 2296-2298.
- Mauro M y Armstrong D. Evaluation of densitometric bone–muscle relationships in Crohn's disease. Bone Junio 2007, vol. 40, n°6: 1610–1614.
- Héla S, et al. Osteoporosis and Crohn's disease. Joint Bone Spine 2005, vol. 72: 403–407.
- Rodriguez S, et al. Surveillance and Management of Dysplasia in Ulcerative Colitis. Gastrointestinal Endoscopy 2007 vol. 65, n°3: 432-439.
- Kayton M. Cancer and Pediatric Inflammatory Bowel Disease. Seminars in Pediatric Surgery 2007, vol. 16: 205-213.
- Scarpa M, Van Koperen P, Ubbink D, Hommes D, Ten Kate F y Bemelman W. Systematic review of dysplasia after restorative proctocolectomy for ulcerative colitis. British Journal of Surgery 2007, vol. 94: 534–545.
|

