Introducción
El interés de la comunidad científica por los folatos y la vitamina B12 se ha visto renovado por el cuerpo de evidencias recientes que asocian el estado carencial de estas vitaminas con efectos adversos en la salud humana, tales como malformaciones congénitas, varios tipos de cáncer, riesgo cardiovascular y alteraciones cognitivas. En esta revisión se actualizan los conocimientos sobre folatos y vitamina B12 en la edad pediátrica, siendo escasa la literatura disponible sobre el tema, especialmente en Chile.
Aspectos bioquímicos y metabólicos
Folato es un término genérico para un complejo de vitaminas B solubles en agua, y que incluye los folatos presentes en el organismo humano y en los alimentos, y también la forma sintética del ácido fólico (ácido pteroilmonoglutámico) usada como medicamento y en la fortificación de alimentos. Se encuentran en vegetales y carnes, particularmente hígado y riñón. Cuando los requerimientos diarios (Tabla 1) no son cubiertos adecuadamente los tejidos pueden depletarse en unos pocos meses. Actúan como un cofactor en diversas reacciones enzimáticas aceptando y transfiriendo 1 carbono (1-C), las que están involucradas en la síntesis, interconversión y modificación de nucleótidos, aminoácidos y otros componentes celulares claves en la síntesis de ADN y proteínas (1).

Los folatos se presentan en los alimentos como poliglutamatos, los que deben ser convertidos a monoglutamatos por la γ-glutamil-hidrolasa localizada en el ribete estriado de los enterocitos del yeyuno. El ácido fólico se absorbe como tal por tratarse de un monoglutamato. Luego, el folato monoglutamato atraviesa la membrana por un mecanismo transportador dependiente del pH. Antes de entrar en la circulación portal, todas las formas de folato sufren la transformación a tetrahidrofolato, y son metilados en las células de la mucosa. La forma predominante en el plasma es el 5-metiltetrahidrofolato, la que es ligada libremente a albúmina, con un pequeño porcentaje unido con alta afinidad a la proteína ligadora de folato. El transporte de folatos a través de las membranas de ciertos tejidos, incluyendo riñón, placenta, y plexo coroideo, ocurre vía proteína ligadora de folato asociada a membranas, que actúa como un receptor de membranas, facilitando así el ingreso tisular de folato. Una vez dentro de las células, el 5-metiltetrahidrofolato es demetilado y convertido a la forma poliglutamato por una sintetasa. Debido a que el folato poliglutamato no atraviesa las membranas celulares como resultado de la carga de su cadena lateral, el folato queda secuestrado dentro de la célula. Antes que sea liberado de los tejidos a la circulación, el folato poliglutamato es reconvertido a monoglutamato por la hidrolasa poliglutamato (1, 2).
El término cobalamina se refiere a una familia de compuestos que comparten una estructura básica. La vitamina B12 es una cobalamina que resulta de la unión de cuatro anillos pirrólicos formando un grupo macrocíclico (núcleo corrina, por lo que pertenece al grupo de los corrinoides), en torno a un átomo central de cobalto (Co). Posee además un grupo radical que, dependiendo del tipo, origina los diversos derivados de la cobalamina. Por ejemplo se llama cianocobalamina si es un grupo CN, e hidroxicobalamina si es un grupo OH. Las dos formas de cobalamina con rol de coenzimas activas en humanos son metilcobalamina y 5' deoxiadenosil cobalamina (conocida como coenzima B12) (3).
La cobalamina es sintetizada por microorganismos, está presente en carnes, pescado y productos lácteos, y no se encuentra en frutas ni vegetales. Los requerimientos dietéticos de cobalamina en niños se detallan en la Tabla 1. Para que los depósitos se depleten, a diferencia de los de folatos, se requieren años de ingesta deficiente.
En el estómago la cobalamina es liberada de las proteínas a través de la digestión y se une al factor intrínseco, producido en el antro gástrico. El complejo factor intrínseco-cobalamina se une a un receptor específico en el intestino delgado, atraviesa las células de la mucosa, entra en la circulación portal, y se liga a la transcobalamina II, que es una proteína transportadora intracelular encargada de entregar cobalamina a los tejidos. Transcobalamina I y III son secretadas principalmente por las células de las glándulas salivales y neutrófilos, y unen cobalamina y análogos. La mayoría de la cobalamina circulante lo hace unida a transcobalamina I, siendo ésta sólo captada por las células del hígado. En la célula, la cobalamina es metabolizada en la mitocondria a adenosilcobalamina, que se requiere para el metabolismo del ácido metilmalónico. En el plasma la principal forma de cobalamina es la metilcobalamina, cofactor de la enzima metionina sintetasa, que tiene por función transferir un grupo metilo del metilhidrafolato a homocisteína para generar metionina y tetrahidrofolato (2).
Etiopatogenia de la deficiencia
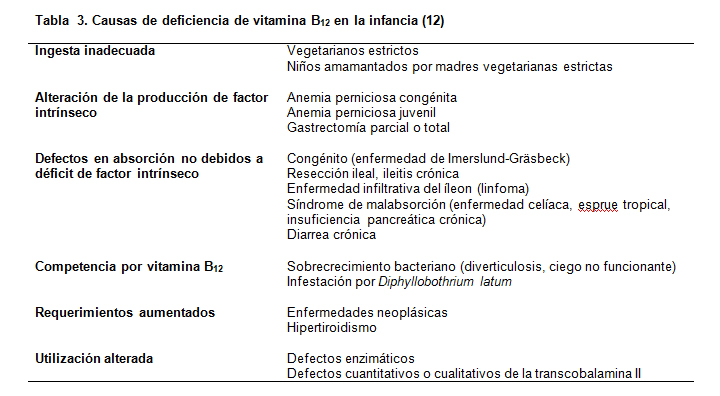
Las causas de deficiencia de folato y vitamina B12 en la edad pediátrica se muestran en las Tablas 2 y 3. El déficit de folato muy pocas veces se presenta al nacimiento, y se ha demostrado que los niveles de folato plasmático son más altos en la sangre de cordón que en la sangre materna (4). Recientemente, en comunidades rurales de México, se ha demostrado alta incidencia de niveles bajos de folato y hemoglobina en mujeres que amamantan. La leche materna aportaba sólo el 70% de la ingesta de folatos recomendada en lactantes, quedando aún bajo interrogante si este nivel es suficiente para los lactantes o es causa de una situación deficitaria (5).

La causa más común de déficit de cobalamina en los lactantes es la ingesta deficiente de la madre (2). Múltiples son los trabajos que relacionan dietas vegetarianas con bajos niveles de cobalamina en adultos (6, 7, 8). El nivel de cobalamina en el recién nacido es alto y disminuye durante las primeras seis semanas, ocurriendo un patrón inverso en las madres. El estatus materno de vitamina B12 predice y se relaciona directamente con el del niño al nacimiento (9, 10), y la paridad de la madre es un fuerte predictor de indicadores de B12 a las 6 semanas (9).
En 1978 se describió el caso de un lactante de 6 meses alimentado exclusivamente al pecho por una madre estrictamente vegetariana, y que presentaba un déficit severo de vitamina B12. La madre era asintomática, pero tenía niveles de ácido metilmalónico elevados en orina, lo que sería la primera manifestación de un déficit funcional de vitamina B12 (11). Además, en un estudio con adolescentes, se demostró que una dieta macrobiótica en la infancia temprana resulta en un deterioro del estatus de cobalamina durante la adolescencia (12). Otro grupo que aparece implicado en las deficiencias son los niños parasitados, aunque los estudios publicados hasta el momento no son concluyentes (13).
Algunas drogas anticonvulsivantes han sido asociadas con bajos niveles de folato séricos y eritrocitarios, y altos niveles de homocisteína en plasma (14, 15, 16). Se ha planteado que el mecanismo por el cual ocurre es la inducción de enzimas hepáticas, demostrándose que los anticonvulsivantes que son inductores, como fenobarbital y carbamazepina, presentan niveles de folatos significativamente menores que pacientes tratados con anticonvulsivantes no inductores, como ácido valproico; así esta inducción enzimática podría jugar un rol fundamental en la deficiencia de folatos (17).
En una revisión publicada en 1999, por Rosenblatt y Whitehead, se tratan en forma extensa las deficiencias de folato y cobalamina en niños, relacionadas con enfermedades hereditarias del metabolismo de estos micronutrientes (2).
Indicadores de deficiencia
Clásicamente, para la medición de niveles de cobalamina se han usado valores séricos, plasmáticos y urinarios, y para folato niveles séricos, eritrocitarios y en sangre total. Cuando se mide folato sérico, se tiene una información de la ingesta de folato de las últimas 24 horas, a diferencia del folato en eritrocitos o sangre total, donde lo que se evalúa es un tejido, y la información nos traduce los depósitos del organismo.
En los últimos años la medición de los marcadores metabólicos ácido metilmalónico (MMA) y homocisteína (tHcy), se ha hecho imprescindible. Holo-transcobalamina ha sido propuesta recientemente como un marcador precoz de la función de cobalamina, habiendo sido evaluada sólo en adultos (18). MMA es un marcador de función de cobalamina sensible y específico que se altera en la deficiencia de vitamina B12, pero también por la presencia de falla renal o de errores del metabolismo que producen alteración de la metilmalonato CoA mutasa. A diferencia de esto, tHcy aumenta tanto con el déficit de folato como de cobalamina, y también en otros procesos patológicos: falla renal, disfunción tiroidea, trasplante de corazón y la fase aguda de un evento cardiovascular (19).
Datos recientes indican que los niveles de folato y cobalamina, incluyendo sus marcadores MMA y tHcy, presentan cambios durante la edad pediátrica, especialmente en el primer año de vida. No existe consenso sobre límites normales de los indicadores en esta edad. Recientemente, en un trabajo realizado en 700 niños entre 4 días y 19 años (20), se proponen valores adecuados para la edad (Tabla 4).
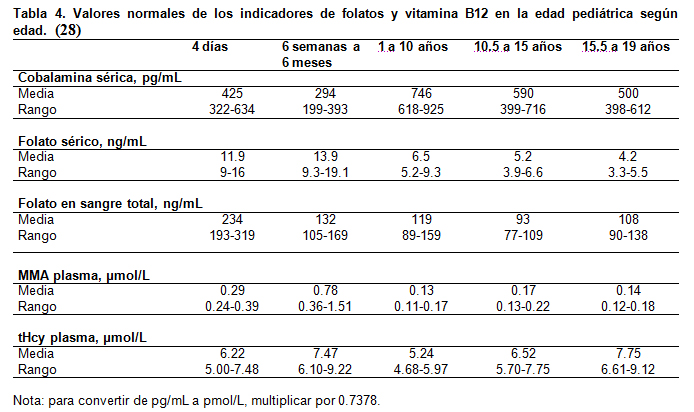
Durante las primeras 6 semanas de vida hay una considerable disminución de los niveles de cobalamina, que se acompaña de un marcado incremento en sus marcadores funcionales MMA y tHcy (9). En lactantes de 6 semanas a 6 meses, las concentraciones de MMA y tHcy son más altas que en otros grupos de edad y están fuertemente correlacionadas con cobalamina y no con folatos. En niños mayores, ambos marcadores muestran relación con cobalamina y folatos (20).
Prevalencia de las deficiencias
Las deficiencias de folato y cobalamina han emergido como un problema importante, principalmente en los países en desarrollo, donde hay escasos estudios publicados. Los trabajos de países desarrollados se refieren a grupos con dietas especiales que no son frecuentes en nuestra región, como vegetarianos.
En comunidades rurales de México se encontró una frecuencia alta de deficiencia de cobalamina, no así de folatos en la población general. En niños entre 18 y 36 meses existía una prevalencia de déficit de cobalamina de 8%, y el 33% presentaba niveles bajos. No se detectaron casos de déficit de folato (21). En Costa Rica se describe una prevalencia de déficit de folato en menores de 7 años de un 11,4%, siendo severa sólo en el 2,3% (22). En Guatemala, en un estudio con niños entre 8 y 12 años de edad, se encontraron bajos niveles de vitamina B12 en el 11% y niveles marginales en el 22%. Con respecto a folato los porcentajes fueron 0 y 1% respectivamente (23).
En un reciente análisis de la situación de Venezuela, se informan valores bastante más alarmantes, siendo la incidencia nacional de déficit de folato de un 31,5% y de cobalamina de un 11,4%. Más aún, en el estado de Vargas, la deficiencia de folato en el lactante alcanza a un 46,2%, llegando a la cifra más alta en las mujeres adolescentes, con un 81,7%. En este mismo informe, la deficiencia de cobalamina en lactantes es de 31,1%, en preescolares de 35%, y en escolares 27,5% (24).
En Chile, datos publicados muestran bajos niveles de deficiencia de folato. A los 3 y 15 meses sólo el 0 y 2,1% presentaba concentraciones de folato en suero bajo lo normal, mientras que en glóbulo rojo 2,5 y 9% respectivamente (25). En escolares la deficiencia de folato sérico fue de 1,2% y folato eritrocitario 6% (26). Cabe recordar que estos trabajos fueron realizados previamente al inicio de la fortificación de la harina de trigo con ácido fólico, por lo que en la actualidad lo más probable es que la deficiencia haya desaparecido en el grupo de escolares debido al alto consumo de pan. En Chile, en un grupo de lactantes marásmicos de 2 a 22 meses se encontró una mayor prevalencia de déficit de folato sérico (47,5%) y eritrocitario (20%) (27).
No hay estudios publicados en Chile sobre el estado nutricional de poblaciones de niños y adolescentes vegetarianos.
El análisis de estos estudios se dificulta por varios factores. Primero, existe una gran variabilidad con respecto a los puntos de corte usados. Segundo, está demostrado que no es posible comparar muestras analizadas en distintos laboratorios, con diferentes técnicas. Se producen diferencias entre 2 y 9 veces los valores, siendo mayor cuando se acerca a los niveles más bajos (28). Tercero, la mayoría de ellos sólo mide niveles plasmáticos de las vitaminas y no sus marcadores funcionales ácido metilmalónico (MMA), homocisteína (tHcy) y holo-transcobalamina, como revisaremos más adelante.
Consecuencias de las deficiencias
Las deficiencias de estos micronutrientes han sido implicadas en varios ámbitos de la pediatría durante los últimos años. Sin lugar a dudas el mayor beneficio de la suficiencia de folato durante el periodo periconcepcional es la prevención de los defectos de tubo neural (DTN) (2). Para lograr la prevención de DTN se ha recurrido a la fortificación de harinas y otros cereales con ácido fólico en países como EEUU, Canadá y Chile. Desde el año 2000 se fortifica la harina de trigo en Chile, de tal manera que 100 g de pan aportan alrededor de 180 μg de ácido fólico. Se evaluó el estatus de folatos de 751 mujeres en edad reproductiva en Chile en la época previa a la fortificación, encontrándose una media de folato sérico de 9,7 ±4,3 nmol/L y de folato eritrocitario de 290 ±102 nmol/L, comparado con 37,2 ±9,5 y 707 ±179 nmol/L respectivamente; en las 605 mujeres que fueron seguidas posteriormente a la fortificación (p<0.0001), lo que indica un significativo incremento (29). No se han medido aún niveles de folatos en niños, aunque lo más probable es que exista un aumento del estatus luego de la intervención.
Frente al aumento de la ingesta de ácido fólico han aparecido varias inquietudes. En un estudio retrospectivo publicado en el año 2001, se analizaron los niños tratados por leucemia linfoblástica aguda (LLA) común en un periodo de 8 años, comparándolos con un grupo control. Se encontró una relación protectora de la ingesta materna de ácido fólico durante la gestación, sin especificaciones de tiempo ni duración, que disminuiría el riesgo de presentar LLA en la infancia (30). Por el contrario, en un reciente estudio canadiense no se encuentra asociación entre el inicio de la fortificación de la harina con ácido fólico y una disminución de las leucemias, relación que sí aparece al estudiar el neuroblastoma en menores de un año, cuya incidencia disminuyó en un 60% (31).
En niños con síncope y bajo tratamiento anticonvulsivante se han relacionado un aumento de los niveles de homocisteína en plasma y la deficiencia de folatos, sugiriéndose así que la suplementación dietética de folatos en niños que reciben tratamiento antiepiléptico debería estar indicada (32).
Con respecto a la cobalamina, su mayor implicancia ha sido con el desarrollo neurológico. En 1978 se describe un síndrome en un lactante alimentado al pecho exclusivo por una madre vegetariana estricta, causado por un déficit severo de vitamina B12. El paciente presentaba un profundo estado de coma, anemia megaloblástica severa, hiperpigmentación de extremidades, aciduria metilmalónica y homocistinuria, presentando respuesta completa al tratamiento con aporte de cobalamina oral y parenteral (11). Se describe un patrón clínico entre los 4 y 8 meses de edad, consistente en irritabilidad, apatía, anorexia y rechazo por los sólidos, regresión del desarrollo psicomotor y pérdida de los hitos ya alcanzados, especialmente motores, detención de la curva de crecimiento, incluyendo circunferencia craneana, hipertonía, hiperreflexia y movimientos coreoatetósicos. Dos de estos niños presentaron a largo plazo un desarrollo intelectual pobre (33).
Se han realizado también estudios que analizan las eventuales consecuencias en adolescentes. Se demostró una significativa asociación entre altos niveles séricos de MMA, relacionados con bajos niveles de cobalamina en adolescentes macrobióticos, con puntajes disminuidos de inteligencia fluida, habilidad espacial y memoria a corto plazo. Los mecanismos por los que la deficiencia de cobalamina causa disfunción cognitiva aún quedan por aclarar (34).
En relación con otra consecuencia referida habitualmente por la literatura, la anemia megaloblástica, en 1992 se publicó una revisión de la etiología de las macrocitosis, analizándose 146 niños entre 6 meses y 12 años con volumen corpuscular medio mayor al percentil 97. De ellos, la primera causa de macrocitosis fue la acción de drogas, y la segunda las cardiopatías. No hubo casos de déficit de folato o vitamina B12 (35).
En 2002, en India, se examinaron todos los ingresos por anemia megaloblástica en un hospital pediátrico, de pacientes entre 6 meses y 12 años. Se encontró una prevalencia de déficit de folato en el 50% de los casos, déficit de cobalamina en el 62% y mixta en el 30%. Además el 50% tenía neutropenia y el 80% trombocitopenia (10).
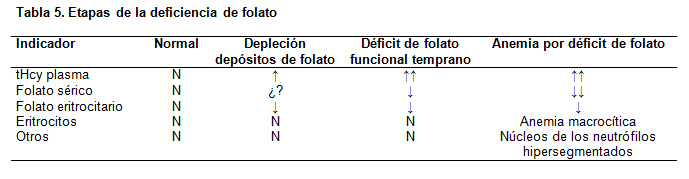
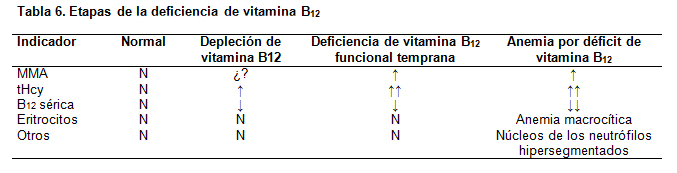
En las tablas 5 y 6 se muestran los marcadores de laboratorio de las deficiencias de folato y B12, en sus distintas etapas.
Conclusiones
En el ámbito pediátrico se ha considerado por muchos años que las deficiencias de estos micronutrientes son hechos aislados, en pacientes muy especiales. Sin embargo, en una mirada a nuestra región, parece ser que la deficiencia de cobalamina sigue siendo un problema de relativa frecuencia, y que la deficiencia de folato presenta una incidencia altamente variable.
En Chile, con lo escasos datos publicados, estas deficiencias en nuestra población pediátrica constituyen un problema marginal, sobretodo después de la fortificación de la harina de trigo a partir del año 2000.
No se puede dejar de mencionar como una limitante fundamental para esta revisión la falta de consenso acerca de los rangos de valores considerados normales para las edades pediátricas.
Referencias
- Bailey L., Moyers S., Gregory J. Folate. Present knowledge in nutrition. 8th ed. 2001 ILSI Press Washington, DC. Chapter 21: 214-228.
- Rosnblatt D., Whitehead V. Cobalamin and Folate deficiency: Acquired and Hereditary Disorders in Children. Seminars in Hematology 1999; 36: 19-34.
- Herbert V. Vitamin B12. Present knowledge in nutrition. 8° Edición. Chapter 20: 191-204.
- Henderson G., Pérez T., Schenker T., et al. Maternal to fetal transfer of 5-methyltetrahydrofolate by the perfused human placental cotyledon: Evidence for a concentrative role by placental folate receptors in fetal folate delivery. J Lab Clin Med 1995; 126: 184-203.
- Villalpando S., Latulippe M., Rosas G., Irurita M., Picciano M and O’Connor D. Milk folate fut not milk iron concentrations may be inadequate for some infants in a rural farming community in San Mateo, Capulhuac, Mexico. Am J Clin Nutr 2003; 78: 782-789.
- Obeid R., Geisel J., Schorr H., Hubner U., Herrman W. The impact of vegetaranism on some haematological parameters. Eur J Haematol 2002; 69(5-6): 275-279.
- Kwok T., Cheng G., Woo J., Lai W., Pang C. Independent effect of vitamin B12 deficiency on hematological status in older Chinese vegetarian womwn. Am J Haematol 2002; 70(3): 186-190.
- Pongstaporn W., Bunyaratavej A. Hematological parameters, feritin and vitamin B12 in vegetarians. J Med Assoc Thai 1999; 82(3): 304-311.
- Bjorke A., Ueland P., Vollset S., Guttormsen A. Et al. Determinants of cobalamin status in newborns. Pediatrics 2001; 108(3): 624-630.
- Chandra J., Jain V., Narayan S. et al.Folate and cobalamin deficiency in megaloblastic anemia in children. Indian Pediatrics 2002; 39: 453-457.
- Higginbottom M., Sweetman L., Nyham W. A Syndrome of Methylmalonic Aciduria, Homocystinuria, Megaloblastic Anemia and Neurologic Abnormalities in a Vitamin B12 Deficient Breast-Fed Infant of a Strict Vegetarian. N Engl J Med. 1978 Aug 17; 299(7): 317-23.
- Van Dusseldorp M., Schneede J., Resfum H. Et al. Risk of persistent cobalamin deficiency in adolescents fed a macrobiotic diet in early life. Am J Clin Nutr 1999; 69: 664-71.
- Olivares J., Fernández R., Fleta J., Ruiz M., Clavel A. Vitamin B12 and Folic Acid in Children with Intestinal Parasitic Infection. J Am Coll Nutr. 2002 Apr; 21(2): 109-13.
- Sakamota A., Eguchi T., Fujita N., Nomura S., Sakura N., Ueda K. Plasma total homocysteína concentrations in epilectic patients taking anticonvulsants. Metabolism 1997; 46(8): 959-962.
- Apeland T., Mansoor M., Strandjord R., Vefring H., Kristensen O. Folate, homocysteine and methionine loading in patients on carbamazepine. Acta Neurol Scand. 2001; 103(5): 294-299.
- Verrotti A., Pascarella R., Trotta D., Giuva T., Morgese G., Chiarelli F. Hyperhomocysteinemia in children treated with sodium valproate and carbamazepine. Epilepsy Res 2000; 41(3): 253-257.
- Kishi T., Fujita N., Eguchi T., Ueda K. Mechanism for reduction of serum folate by antiepilectic drugs during prolonged therapy. J Neurol Sci. 1997; 145(1): 109-112.
- Nexo E., Hvas A., Bleie O. et al. Holo-Transcobalamin Is an Early Marker of Changes in Cobalamin Homeostasis. A Randomized Placebo-controlled Study. Clinical Chemistry 2002; 48 (10): 1768-1771.
- Bjorke A. and Ueland P. Homocysteine and methylmalonic acid in diagnosis and risk assessment from infancy to adolescence. Am J Clin Nutr 2003; 78: 7-21
- Bjorke A., Refsum H., Markestad T. and Ueland P. Cobalamin Status and Its Biochemical Markers Methylmalonic Acid and Homocysteine in Differente Age Groups from 4 Days to a 19 Years. Clinical Chemistry 2003; 49(12): 2067-2075.
- Allen L., Rosado J., Martinez H., López P., Muñoz E. and Black A. Vitamin B12 deficiency and malabsortion are highly prevalent in rural mexican communities. Am J Clin Nutr 1995 Nov; 62(5): 1013-1019.
- Cunningham L., Blanco A., Rodríguez S., Ascencio M. Prevalencia de anemia, deficiencia de hierro y folatos en niños menores de siete años. Costa Rica 1996. Arch Latinoamer Nutr 2001; 51: 37-43.
- Rogers L., Boy E., Millar J., Green R., Sabel J. and Allen L. High prevalence of cobalamin deficiency in Guatemalan schoolchildren: association with low plasma holotranscobalamin II and elevated serum methylmalonic acid and plasma homocysteine concentrations. Am J Clin Nutr 2003; 77: 433-440.
- García M. Situación de ácido fólico, vitamina B12 en niños, adolescentes, y mujeres embarazadas de Venezuela. IVIC-FUNDACREDESA-INN. Instituto venezolano de investigaciones científicas, Caracas, Diciembre del 2003.
- Olivares M., Anderson M., Llaguno S., Steckel A. Folato sérico y eritrocitario en el lactante. Rev Chilena de Pediatría 1983; 54: 246.
- Olivares M., Llaguno S., Cayazzo M., Steckel A. Nutrición de folato en escolares. Rev Chilena de Pediatría 1985; 56(3): 157-159.
- Olivares M., Hertrampf E., Llaguno S., Chadud P., Steckel A. Folic Acid Nutrition in Marasmic Infants. Nutrition Research 1986; 6: 1365-1370.
- Gunter E., Bowman B., Caudill S., Twite D., Adams M. And Sampson E. Results of an international round robin for serum and whole-blood folate. Clin Chem 1996 Oct; 42(10):1689-1694.
- Hertrampf E., Cortés F., Erickson J. et al. Consumption of Folic Acid-Fortified Bread Improves Folate Status in Women of Reproductive Age in Chile. J Nutr 2003; 133: 3166-3169.
- Thompson J, Gerald P, Willoughby M, Armstrong B. Maternal folate suplementation in pregnancy and protection against acute lymphoblastic leukaemia in childhood: a case control study. Lancet. 2001 Dec 8; 358(9297): 1935-40.
- French A., Grant R., Weitzman S. et al. Folic acid food fortification is associated with a decline in neuroblastoma. Clin Pharmacol Ther. 2003; 74(3): 288-94.
- Cardo E., Vilaseca M., Campistol J., Artuch R., Colome C., Pineda M. Evaluation of hyperhomocysteinaemia in children with stroke. Eur J Paediatr Neurol. 1999; 3(3): 113-117.
- Graham S., Arvela O., Wise G. Long-term neurologic consequences of nutritional vitamin B12 deficiency in infants. J Pediatr. 1992; Nov 121(5 Pt 1): 710-4.
- Lowman M., Van Dusseldorp M., Van de Vijver F. et al. Signs of impaired cognitive function in adolescents with marginal cobalamin status. Am J Clin Nutr 2000; 72: 762-769
- Pappo A., Fields B. and Buchanan G. Etiology of Red Blood Macrocytosis during Childhood: Impact of New Diseases and Therapies. Pediatrics 1992; 89: 1063-1067.
|

