Las urgencias oncológicas pueden presentarse durante el debut de una neoplasia o aparecer en el curso de la enfermedad, ya sea como una complicación del tratamiento de ésta o por la progresión de la enfermedad de base. Estas urgencias pueden derivar de alteraciones metabólicas, provocadas por la neoplasia misma o por su tratamiento, o bien ser secundarias a la ocupación de espacios por los tumores que dificultan u obstruyen la función de órganos vitales. En este capítulo sólo abordaremos las más frecuentes.
SÍNDROME DE LISIS TUMORAL
El síndrome de lisis tumoral (SLT) es una alteración metabólica caracterizada por una tríada clásica compuesta de: hiperuricemia, hiperfosfemia e hiperkalemia, asociada frecuentemente a hipocalcemia e insuficiencia renal aguda. Aunque esta alteración metabólica puede presentarse antes de iniciar el tratamiento, lo habitual es que se manifieste dentro de los primeros 3 a 5 días de iniciada la quimioterapia.
Etiología y fisiopatología
El síndrome de lisis tumoral es más frecuente en pacientes que tienen tumores grandes o diseminados, con gran velocidad de crecimiento y además quimiosensibles como son: el linfoma de Burkitt, el linfoma linfoblástico y la leucemia linfoblástica aguda, especialmente las de estirpe T, que frecuentemente cursan con hiperleucocitosis (tabla 1). Otros factores asociados al riesgo de presentar lisis tumoral son la elevación al diagnóstico de la deshidrogenada láctica (LDH), creatinina o ácido úrico, que probablemente sólo reflejen presencia de lisis tumoral espontánea. Es raro que la leucemia mieloide aguda al igual que la crónica, cursen con lisis tumoral a pesar de presentarse con hiperleucocitosis y gran masa tumoral extramedular inicial.
Debido a la rápida destrucción de las células tumorales, se produce una liberación al torrente sanguíneo de metabolitos intracelulares que la excreción renal o el tamponamiento celular no son capaces de compensar.
La hiperuricemia causada por la rápida destrucción de los blastos, sobrepasa la capacidad excretora del riñón, conduciendo a la acumulación de ácido úrico que en pH ácido precipita en los túbulos renales. Esta precipitación de cristales de ácido úrico provoca insuficiencia renal por uropatía obstructiva, lo que agrava aún más la lisis tumoral.
La hiperkalemia debida a la liberación de potasio intracelular y a la falta de depuración por insuficiencia renal, cuando es mayor de 6,5 mmol/l puede llevar a la producción de arritmias cardiacas y muerte. Finalmente, los blastos, especialmente ricos en fosfatos, al destruirse liberan a la circulación este ión. Si la solubilidad del fósforo supera el producto calcio x fósforo mayor a 60, se producen cristales de fosfato de calcio que pueden precipitar en los túbulos renales, aumentando la uropatía obstructiva, o pueden provocar hipocalcemia secundaria. Esta hipocalcemia puede producir hipotensión, compromiso del ritmo cardiaco y efectos neuromusculares como tetania, calambres, parestesias, laringoespasmo, compromiso de conciencia y convulsiones.
Evaluación
En todo paciente con riesgo de desarrollar un síndrome de lisis tumoral se debe realizar una historia y examen físico detallado, además de una evaluación de laboratorio inicial que debe incluir: un hemograma completo, electrolitos plasmáticos, calcemia y fosfemia, nitrógeno ureico, creatinina, ácido úrico y orina completa. Si el calcio está bajo se debe solicitar calcio iónico y albúmina. Un electrocardiograma es esencial si existe hiperkalemia mayor de 6 mEq/l, ya que éste mostrará ensanchamiento del QRS y ondas T picudas.
Tratamiento
Lo más importante en el manejo de la lisis tumoral, es que éste debe ser preventivo, y para ello se debe tener un alto índice de sospecha (tabla 2). Una vez presente la lisis tumoral, el tratamiento debe estar enfocado en la corrección de las alteraciones hidroelectrolíticas presentes y en evitar el desarrollo de la insuficiencia renal

En los pacientes recién diagnosticados de leucemia o linfoma no Hodgkin, las bases del tratamiento de la lisis tumoral son: la hiperhidratación, la alcalinización y el alopurinol. La hidratación es probablemente el factor más crítico. Un aumento en la hidratación se traducirá en una mayor tasa de filtración glomerular y un mayor flujo urinario. Para lograr una adecuada hiperhidratación, se debe administrar entre 3.000 y 6.000 cc/m2/día de solución glucosada al 5% con bicarbonato de sodio (40 a 80 mEq/l) sin potasio ni calcio. El objetivo es lograr una diuresis mayor a 100 cc/m2/hr y un pH urinario entre 7 y 7.5, debido a que entre estos límites de pH el ácido úrico permanece ionizado sin precipitar, y no se formarán cristales de fosfato de calcio que con pH más básico también precipitan. Si el flujo urinario es menor que el esperado se puede aumentar el volumen como se dijo anteriormente hasta 6.000 cc/m2/día y/o forzar diuresis con furosemida 0,5 a 1 mg/kg/dosis o manitol 0,5 mg/kg/ en 15 minutos.
El alopurinol se administra en dosis de 300 mg/m2/día o 10 mg/kg/día fraccionado en 3 dosis. El alopurinol es un análogo de la xantina que se convierte en su metabolito activo, el oxipurinol. El oxipurinol inhibe la xantinooxidasa, enzima responsable de convertir las xantinas e hipoxantinas en ácido úrico (figura 1). Aunque el alopurinol previene la formación de nuevo ácido úrico, no reduce el previamente formado, por lo que necesita alrededor de 2 a 3 días para disminuir la uricemia. El alopurinol se excreta en gran medida por el riñón, motivo por el cual la dosis debe reducirse a la mitad en caso de insuficiencia renal que requiera diálisis.
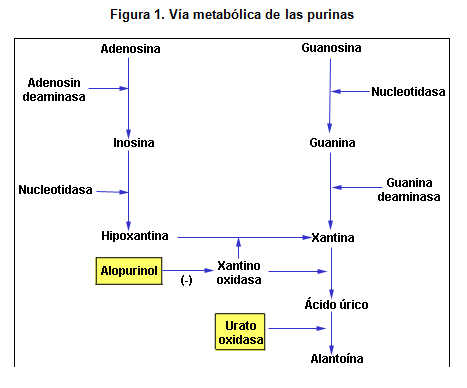 |
Finalmente, en los últimos años se desarrolló la urato oxidasa recombinante, que es una enzima capaz de degradar el ácido úrico a alantoína (figura 1), la cual es mucho más soluble en orina y por lo tanto menos probable que precipite y cause uropatía obstructiva. Esta enzima se usa en dosis de 0,15 mg/kg/día durante 5 a 7 días y logra disminuir la uricemia al cabo de unas pocas horas.
Para corregir la hiperkalemia se pueden usar: resinas de intercambio iónico en dosis de 1 a 2 gr/k/día, bicarbonato de sodio que corrige la acidosis y permite la entrada de potasio a la célula, o suero glucosado al 5% junto con insulina que promueve la entrada de potasio al intracelular. La hiperfosfemia se puede corregir agregando quelantes del fósforo como el hidróxido de aluminio (50 -150 mg/kg/día fraccionado cada 6 a 8 hrs). La hipocalcemia debe tratarse sólo si ésta es sintomática, con gluconato de calcio al 10%: 0,5 ml/kg/dosis.
Por último, si ninguna de las medidas anteriores da resultado, se deberá utilizar la diálisis en las siguientes condiciones:
a._ Deterioro de las alteraciones metabólicas a pesar de tratamiento.
b.- Creatinina > 10 mg/dl
c.- Acido úrico > 10 mg/dl
d.- Potasio > 6 mEq/dl
e.- Fósforo >10 mg/dl
f.- Hipocalcemia sintomática
g.- Anuria u oliguria severa
HIPERLEUCOCITOSIS
Definición y etiología
Hiperleucocitosis se define como un aumento mayor de 100.000 leucocitos en sangre periférica, pero ésta es clínicamente significativa cuando sobrepasa los 200.000 leucocitos en leucemia mieloide aguda (LMA) y los 300.000 leucocitos en leucemia linfoblástica aguda (LLA). La hiperleucocitosis se presenta en el 9 a 14% de las LLA, el 9 a 22% de las LMA y en casi todas las leucemia mieloides crónicas en fase crónica. Las complicaciones derivadas de la hiperleucocitosis que son capaces de producir la muerte son. la hemorragia o trombosis del sistema nervioso central (SNC), la leucostasis pulmonar y las alteraciones que acompañan al síndrome de lisis tumoral (tabla 3). Estas complicaciones causan mayor morbilidad y mortalidad en las leucemia mieloides que en las linfáticas (23% v/s 5%).
Patogenia
La hiperleucocitosis aumenta directamente la viscosidad sanguínea al aumentar el número de leucocitos (partículas), y también en forma indirecta por la mayor tendencia a formar agregados de células leucémicas y trombos leucocitarios. Como los blastos mieloides son de mayor tamaño que los linfáticos, la hiperviscosidad es mayor en la LMA. Estos agregados leucocitarios pueden dañar los endotelios de los vasos sanguíneos y producir hemorragias secundarias, las que pueden causar la muerte cuando ocurren en SNC o pulmón.
Los agregados leucocitarios a nivel pulmonar degeneran y liberan el contenido intracelular al espacio intersticial, conduciendo a daño alveolar.
Evaluación y sintomatología
Un niño con una leucocitosis mayor a 100.000 debe ser derivado rápidamente a un centro de atención terciaria para su correcta evaluación y tratamiento.
Se debe realizar: hemograma completo, electrolitos plasmáticos, calcemia, fosfemia, pruebas de función renal y de coagulación, ya que en la LMA frecuentemente se asocia coagulopatía, aumentando aún más el riesgo de hemorragias.
La sintomatología está dominada por el compromiso neurológico y pulmonar, que se manifiesta como: compromiso de conciencia variable, visión borrosa, diplopía, convulsiones, edema de papila, disnea, hipoxia y cianosis. Además se describe priapismo, engrosamiento del clítoris y dactilitis.
Tratamiento
Como existe riesgo de lisis tumoral, el tratamiento de ésta debe ser instaurado rápidamente con hiperhidratación alcalina y alopurinol o urato oxidasa recombinante. Se debe evitar aumentar la viscosidad con transfusiones innecesarias (especialmente de glóbulos rojos) tratando de alcanzar niveles de hemoglobina normales. Si el recuento plaquetario es menor de 20.000, se debe transfundir plaquetas para disminuir el riesgo de hemorragias.
El recambio sanguíneo con 2 volemias o la leucoaféresis pueden disminuir rápidamente el número de leucocitos y mejorar la coagulopatía.
Todas las medidas antes mencionadas sólo mejoran temporalmente el problema, por lo que se debe iniciar lo antes posible la quimioterapia citoreductora.
En algunos centros se administra radioterapia de cráneo (400 cGy) para prevenir el riesgo de hemorragia de sistema nervioso central.
NEUTROPENIA FEBRIL
Introducción
Las infecciones son una importante causa de morbilidad y mortalidad en pacientes con cáncer. Cada una de las modalidades de tratamiento para el cáncer aumenta el riesgo de infecciones. La mayoría de los medicamentos usados para quimioterapia producen toxicidad medular y de las mucosas, que ponen al paciente en riesgo de infecciones bacterianas o micóticas. Este riesgo está en directa relación con la duración e intensidad de la neutropenia.
Definición
Se define como neutropenia febril (NF) a todo cuadro de neutropenia severa, es decir un recuento absoluto de neutrófilos (RAN) menor a 500, asociado a fiebre mayor o igual a 38,5º C axilar por una vez, o bien dos tomas de 38º C o más separadas por un intervalo de una hora.
La integridad de la piel y de las mucosas es uno de los mecanismos primarios de defensa del huésped. Tanto la quimioterapia como la radioterapia, junto con las punciones venosas o instalación de catéteres venosos centrales, alteran esta barrera permitiendo la colonización y eventual diseminación de gérmenes patógenos. Por otra
parte las células responsables de la respuesta inmune, neutrófilos, linfocitos y monocitos son afectados cualitativa y cuantitativamente por la quimioterapia, lo que conduce a un aumento de la susceptibilidad a las infecciones graves. También es importante la variedad de cáncer que padece el niño, es así como los linfomas de Hodgkin y algunos linfomas no Hodgkin se acompañan de alteraciones en la inmunidad celular que los predisponen a padecer infecciones virales, o la leucemia que al producir neutropenia se acompaña de mayor riesgo de infecciones bacterianas. Finalmente, otros factores que contribuyen a la inmunosupresión son el deterioro del estado nutritivo de los pacientes y el cambio en la flora microbiana habitual.
Los diagnósticos más frecuentemente asociados a neutropenia febril varían según el grupo de riesgo, siendo la fiebre de origen desconocido el más frecuente entre los de riesgo bajo y la bronconeumonía y sepsis entre los de riesgo alto. (Tabla 4).
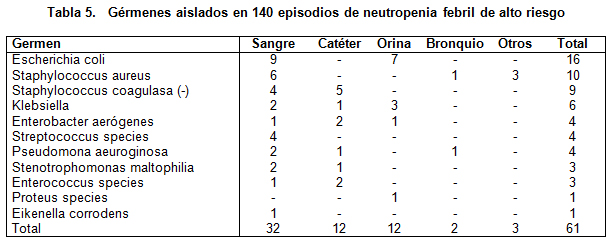
Los gérmenes más aislados en los pacientes con neutropenia febril son la E. Coli y el S. Aureus (Tabla 5).
Evaluación del paciente con fiebre y neutropenia
Desde los años 90, se ha utilizado el concepto de NF de alto y bajo riesgo, en relación a la probabilidad de cursar una infección bacteriana invasiva (IBI). En Chile se han realizado estudios que validaron un modelo de predicción de IBI (tabla 6) que es el que se aplica en los hospitales de Santiago.

Para intentar detectar el foco infeccioso y aplicar el modelo de riesgo se debe realizar al ingreso a todo paciente con fiebre y neutropenia:
- Cuidadosa anamnesis y examen físico, con especial énfasis en mucosas bucal y anal.
- Hemograma con recuento plaquetario
- Proteína C reactiva (PCR)
- Radiografía de tórax ántero-posterior y lateral
- Orina completa y urocultivo
- Hemocultivos periféricos y centrales, cualitativos y cuantitativos
- Muestra de aspirado nasofaríngeo para virus respiratorio sincicial, adenovirus, influenza y parainfluenza
- Punción lumbar (sólo si existe sospecha de infección meníngea)
- Coprocultivo (en caso de diarrea)
- Cultivo de otras secreciones (piel o mucosas)
Se debe recordar que, como se trata de un paciente neutropénico, no se debe esperar que existan síntomas inflamatorios importantes asociados a los probables focos infecciosos.
Manejo del paciente neutropénico febril
Todo paciente neutropénico febril se debe hospitalizar para estudio de su probable foco, como se mencionó anteriormente, y para tratamiento antibiótico. El esquema antimicrobiano a usar debe ser de uso endovenoso y de amplio espectro. Debe cubrir bacilos gram (-) y cocáceas gram (+). En los pacientes de riesgo alto sin foco evidente, se sugiere iniciar el tratamiento con una asociación que incluya un ß-lactámico con actividad antiestafilocócica más un aminoglicósido y una cefalosporina de 3ª generación. En nuestro centro se utiliza cloxacilina + amikacina + cefotaxima y si existe diarrea se adiciona metronidazol.
En pacientes con foco clínico evidente se sugiere agregar al tratamiento de amplio espectro el antimicrobiano más adecuado para el foco.
El seguimiento de estos pacientes se debe realizar con control diario de la evolución clínica, curva febril, hemograma y proteína C reactiva los primeros 3 días, y reevaluación de los cultivos (+) al diagnóstico al 3º día. De acuerdo a estos parámetros, se cataloga al paciente como evolución favorable o desfavorable.
Evolución favorable: Se considera una normalización de la temperatura en las primeras 72 horas, estabilización hemodinámica, resolución de los focos infecciosos si existen, descenso significativo de la proteína C reactiva (30% o menos que el día anterior) y negatividad de los cultivos en caso de positividad de alguno al ingreso.
Si el paciente cumple con los criterios anteriores, lleva 2 días afebril, sin foco infeccioso demostrado, con radiografía de tórax normal y cultivos negativos, se suspenden antibióticos y se da de alta.
Si el paciente evoluciona favorablemente, completa 48 hrs. afebril, con cultivos negativos y radiografía de tórax normal pero con foco aislado, se puede dar de alta con tratamiento antibiótico específico.
Evolución desfavorable: incluye uno o más de los siguientes requisitos: inestabilidad hemodinámica no atribuible a pérdida de volumen, fiebre persistente, aparición de un nuevo foco infeccioso, PCR estacionaria o en ascenso, o persistencia de cultivos positivos luego de 72 horas de tratamiento.
Si un paciente evoluciona des-favorablemente, se debe cambiar de antibióticos tomando en cuenta la bacteriología. Si no hay foco o hallazgos bacteriológicos se debe cambiar a vancomicina +amikacina +Ceftazidima. De persistir febril al 5º día de tratamiento se debe cambiar a vancomicina + imipenem y si al 7º día mantiene una evolución desfavorable se agrega anfotericina-B. (Figura 2).
Referencias
- Pizzo P., Poplack D. Principles and practice of Pediatric Oncology 4th edition, Philadelphia, Lippincott Williams & Wilkins, 2002; 1177-1203.
- Madero L., Muñoz A. Hematología y oncología pediátricas 1ª edición, Madrid, Ediciones Ergon S.A., 1997; 353-369. ISBN 84-89834-21-0
- Pinkerton R., Plowman P., Pieters R. Paediatric Oncology 3rd edition, London, Arnold, 2004; 623-649. ISBN 0-340-80775-X
- Sima J. Tumor Lysis Syndrome. Seminars in Hematology 2001; 38(4): 4-8.
- Patte C., Sakiroglu O., Sommelet D. European Experience in the Treatment of Hyperuricemia. Seminars in Hematology 2001; 38(4): 9-12.
- Pui C. Urate Oxidase in the Prophylaxis of Hyperuricemia: The United States Experience. Seminars in Hematology 2001; 38(4): 13-21.
- Santolaya M., Alvarez A., Avilés C. Tratamiento selectivo de los episodios de neutropenia febril en niños con cáncer. Comité de infectología, PINDA. Rev Chil Infect 2004; 21(3): 213-222.
- Santolaya M., Alvarez A., Avilés C. Prospective evaluation of a model of prediction of invasive bacterial infection risk among children with cancer, fever, and neutropenia. Clinical infection disease 2002; 35: 678-683.
- Santolaya M., Alvarez A., Becker A. Prospective, multicenter evaluation of risk factors associated with invasive bacterial infection in children with cancer, neutropenia and fever. Journal of clinical oncology 2001; 19(14): 3415-3421.

