I. INTRODUCCIÓN
Se denomina derrame paraneumónico o pleuroneumonía a la acumulación de líquido en la cavidad pleural que ocurre como complicación de una neumonía, empleándose el término de empiema cuando este líquido corresponde a pus.
Esta patología tiene una incidencia aproximada de 3 por 100.000 niños, afectando mayormente preescolares y lactantes, con un promedio de edad de presentación de 2.9 años. En Chile, aproximadamente el 2% de las hospitalizaciones por causa respiratoria, se deben a esta patología.
El derrame paraneumónico evoluciona en tres fases:
1. Fase exudativa: Inflamación pleural que lleva a la acumulación de líquido de aspecto claro y con escasa cantidad de neutrófilos.
2. Fase fibrinopurulenta: En esta etapa se incrementa el infiltrado de glóbulos blancos, el depósito de fibrina y hay formación de septos o loculaciones en la cavidad pleural.
3. Fase organizacional: Los fibroblastos infiltran a la cavidad pleural y se produce una reorganización de los septos con formación de membranas gruesas.
II. CUADRO CLÍNICO
Los pacientes en su mayoría manifiestan los síntomas y signos clásicos de una neumonía adquirida en la comunidad (NAC) que se caracteriza por la presencia de fiebre, tos, decaimiento, inapetencia y distintos grados de dificultad respiratoria, agregándose en ocasiones dolor torácico tipo pleurítico, lo que hace sospechar la presencia de un derrame paraneumónico. Al examen físico se puede detectar una disminución en la expansión torácica, incluso observarse escoliosis cóncava hacia el lado del derrame, el murmullo vesicular se encontrará muy disminuido o abolido y a la percusión se detectará matidez del lado afectado.
Muchas veces nos enfrentamos a esta patología en pacientes con diagnóstico de NAC y que estando en tratamiento, evolucionan desfavorablemente. Por este motivo se recomienda control médico y examen físico dirigido a buscar complicaciones en todo paciente con NAC que persiste con fiebre o con evolución desfavorable luego de 48 horas de tratamiento y en este caso, se debe complementar la evaluación con una radiografía de tórax.
III. EXÁMENES DE APOYO DIAGNÓSTICO
1. ESTUDIO DE IMÁGENES
1.a Radiografía de tórax
Es el principal examen diagnóstico para pleuroneumonía. Se sugiere solicitar una radiografía de tórax anteroposterior y lateral a todo paciente que esté cursando con una neumonía condensante y con mayor razón cuando existen elementos al examen físico que orienten a un compromiso pleural o presenten una evolución desfavorable. La traducción del derrame en las imágenes dependerá de la posición en que se realiza el examen, de la cuantía del líquido y de la presencia de tabicaciones.
El elemento radiológico inicial es el velamiento del ángulo costofrénico, siempre que la radiografía se haya tomado en posición de pie, si fue tomada en posición supina se puede observar un aumento de opacidad de todo el campo pulmonar afectado y se debe buscar una separación de la silueta pulmonar con respecto a la pared torácica, tal como se muestra en la Figura nº1. 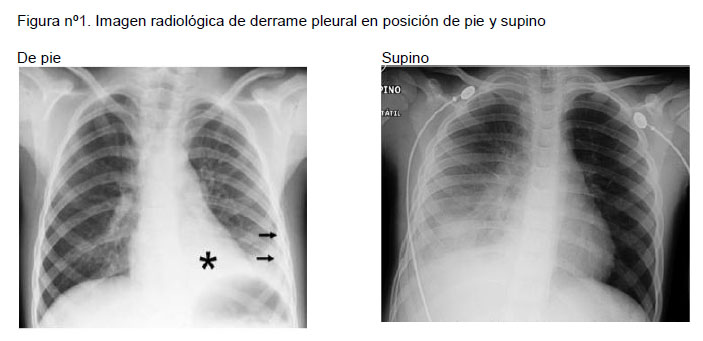
La radiografía en decúbito lateral no aporta mayor información que la Radiografía anteroposterior, por lo que no debe solicitarse.
Cuando el derrame pleural es extenso puede ser difícil diferenciarlo de una gran condensación o de una atelectasia masiva. Aquí ayuda la evaluación de la posición del mediastino y de la columna, ya que el derrame puede generar una desviación del mediastino hacia el lado contralateral y producir una escoliosis cóncava hacia lado del derrame.
1.b Ecografía
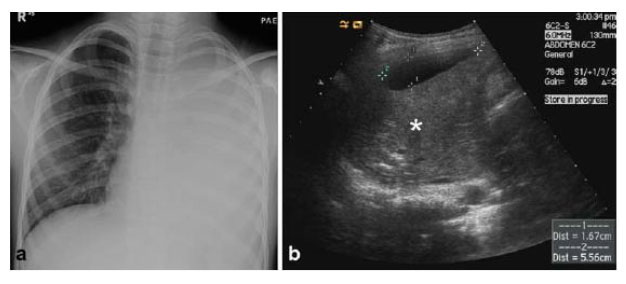
Es un examen de mucha utilidad tanto para el diagnóstico como para el tratamiento de las pleuroneumonías ya que permite confirmar presencia de líquido, definir la cuantía del derrame y evaluar su apariencia en cuanto a la presencia de fibrina, septos y
engrosamiento pleural. Además ayuda a guiar procedimientos como la toracocentesis y da información que contribuye a la toma de decisiones terapéuticas.
A través de la ecografía es posible hacer una clasificación de los derrames paraneumónicos y dividirlos en los de “bajo grado” que se caracterizan por ser libres y anecogénicos, a diferencia de los de “alto grado” que contienen fibrina, septos, loculaciones y/o engrosamiento pleural. Esta clasificación permite al clínico predecir mejor la evolución de la enfermedad y orientar las conductas terapéuticas.
Dado que en nuestra realidad hospitalaria no contamos las 24 hrs. del día con ecografía, las conductas diagnósticas y terapéuticas como realizar una toracocentesis e instalar un tubo de drenaje pleural nunca deben retrasarse por la espera de este examen.
1.c Tomografía computada
La Tomografía computada no debe solicitarse de rutina en esta patología ya que no aporta mayor información que la ecografía, no permite diferenciar un derrame no complicado de un empiema y además implica una alta irradiación para el paciente. Puede ser necesario realizar una tomografía para el estudio de posibles patologías pulmonares subyacentes, cuando no hay normalización de la radiografía de tórax una vez superado el cuadro agudo.
2. HEMOGRAMA Y REACTANTES DE FASE AGUDA
El hemograma y la fórmula diferencial de leucocitos permiten orientar acerca de la etiología infecciosa, encontrándose habitualmente leucocitosis con predominio de neutrófilos y desviación de la serie blanca hacia izquierda, asociado a aumento de VHS y PCR. En caso de encontrar predominio linfocitario, debemos sospechar otras etiologías como la Tuberculosis. El recuento de glóbulos blancos la PCR, VHS, y en los casos más graves la procalcitonina y albumina, son exámenes de gran utilidad para monitorizar la evolución de la enfermedad y evaluar la respuesta al tratamiento.
3. ESTUDIO DEL LÍQUIDO PLEURAL
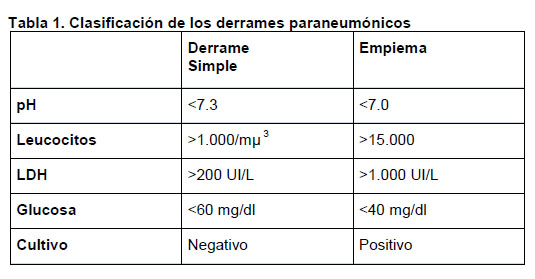
A todo paciente con derrame paraneumónico, al momento del diagnóstico, debe extraerse una muestra de líquido pleural para realizar estudio químico, citológico y microbiológico del derrame. Es muy importante no retrasar este procedimiento e idealmente realizarlo previo al inicio del tratamiento antibiótico, para mejorar la detección del microorganismo involucrado y optimizar el tratamiento del paciente. Los derrames paraneumónicos por definición corresponden a exudados y según las alteraciones encontradas los podremos clasificar en derrames simples o empiema, como se muestra en la tabla nº 1. Algunos emplean además el término de derrame
complicado en aquellos que tienen todas las características de empiema, pero con pH entre 7 y 7.2, y en este caso también se requiere de instalación de drenaje pleural.
4. EXÁMENES MICROBIOLÓGICOS
4.a Hemocultivos
Los hemocultivos deben solicitarse a todo paciente con pleuroneumonía, idealmente previo al inicio de tratamiento antibiótico. En nuestro medio tienen una baja positividad, siendo cercana al 6% en caso de neumonía y 10% en empiema, pero se insiste en tomarlos ya que puede ser el único método que permita confirmar la etiología.
4.b Cultivos de líquido pleural
Los cultivos de líquido pleural tienen un mejor rendimiento que los hemocultivos, pero en nuestro medio generalmente resultan negativos por uso previo de antibióticos.
4.c Técnicas moleculares (PCR)
La amplificación del ADN por la reacción en cadena de la polimerasa (PCR) ha permitido mejorar identificación etiológica, pero aún no se realizan en forma generalizada, por su alto costo y falta de implementación en los laboratorios.
4.d Otros estudios
En sospecha de tuberculosis se debe solicitar ADA (Adenosin de aminasa) en líquido pleural y valores superiores a 40-45 UI/l tienen una sensibilidad cercana al 100% y una especificidad del 90% para el diagnóstico de tuberculosis. La medición de interferón gamma, (linfocina liberada por los linfocitos T CD4+), también ha mostrado una alta sensibilidad y especifidad (>95%) para identificar pleuresías tuberculosa.
IV. TRATAMIENTO
El tratamiento del derrame paraneumónico siempre debe realizarse hospitalizado y los pilares del tratamiento son el tratamiento antibiótico y el drenaje de la cavidad pleural
1. Tratamiento Antibiótico
Todo paciente con diagnóstico de pleuroneumonía debe recibir tratamiento antibiótico endovenoso y en los casos asociados a NAC se debe optar por un antibiótico con cobertura para el principal agente etiológico que es el Streptococcus Pneumoniae (neumococo), siendo la penicilina sódica el antibiótico de elección. En pacientes alérgicos a penicilina puede emplearse clindamicina. En los casos de infecciones intrahospitalarias o en aquellas asociadas a cirugía, trauma o aspiración de contenido digestivo, se debe ampliar el espectro de cobertura considerando microorganismos anaerobios y si se trata de pacientes inmunocomprometidos deben utilizarse antibióticos de amplio espectro.
Cuando el paciente ingresa en condición grave o en aquellos en que la respuesta a tratamiento con penicilina no ha sido
favorable, se debe considerar terapia antibiótica con cobertura para Staphyloccus Aureus y neumococos resistentes a penicilina. Se debe considerar el uso de macrólidos, cuando la respuesta al tratamiento no es la esperada y en escolares o adolescentes ya que el Mycoplasma Pneumoniae también puede causar pleuroneumonías, pero rara vez se asocia a empiemas.
No existe evidencia que permita establecer con precisión la duración del tratamiento antibiótico. Se recomienda mantener el tratamiento endovenoso hasta que ceda la fiebre y mientras se mantenga con tubo de drenaje pleural y luego completar con antibiótico oral entre 1 y 4 semanas de tratamiento, lo que dependerá de la persistencia de síntomas y de la presencia de complicaciones.
2. Drenaje de la cavidad pleural
2.a Toracocentesis
Es el procedimiento mediante el cual se extrae líquido de la cavidad pleural. En el caso de una pleuroneumonía tiene fines diagnósticos ya que el análisis de las características del líquido pleural permite una evaluación completa del cuadro y en ocasiones tiene un rol terapéutico al descomprimir la cavidad pleural.
La toracocentesis debe realizarse al momento del diagnóstico, idealmente previo al inicio del tratamiento antibiótico, cuando la cantidad de líquido pleural haga posible este procedimiento. Se asume que esto ocurre cuando se observa un derrame > 1 cm en la radiografía de tórax.
Se debe realizar bajo sedación, manteniendo al paciente monitorizado con saturometría contínua, con control de signos vitales frecuente, manteniendo un adecuado control de la vía aérea y ventilación, con un acceso venoso permeable y equipo de resucitación disponible.
El sitio de punción, puede ser determinado a través de una ecografía, pero de no contar con este examen y evitando el retraso del procedimiento, se debe optar por el sitio que ofrece mayor facilidad de obtener una muestra adecuada, sin complicaciones, que corresponde al quinto espacio intercostal (a la altura de las mamilas) en línea axilar media o axilar posterior, siempre sobre la costilla inferior de este espacio, para no lesionar el paquete vasculonervioso.
El sitio de punción debe ser previamente desinfectado y protegido con un campo estéril. Se debe administrar anestesia local y luego introducir un trócar o aguja conectado a un sistema que permita un flujo unidireccional de aire o fluido al tórax, con una llave de tres pasos, que permita obtener las distintas muestras, sin riesgo de generar un neumotórax.
2.b Tubo de Drenaje Pleural
Se debe instalar un tubo de drenaje pleural en presencia de derrame pleural paraneumónico complicado o empiema. Este procedimiento puede ser realizado por todo médico cirujano, quien debe conocer la técnica y haber recibido capacitación en el procedimiento.
Se puede realizar en la cama del paciente, revisando que se disponga de todos los insumos necesarios: tubos de drenaje, frascos, conexiones, anestesia local, bisturí, sutura, guantes, ropa estéril, sistema de monitorización, etc. Al igual que en la toracocentesis, el paciente debe tener una vía venosa permeable y estar adecuadamente monitorizado. No se requiere de anestesia general pero el procedimiento se debe realizar bajo sedación, analgesia y anestesia local, utilizando técnica estéril estricta.
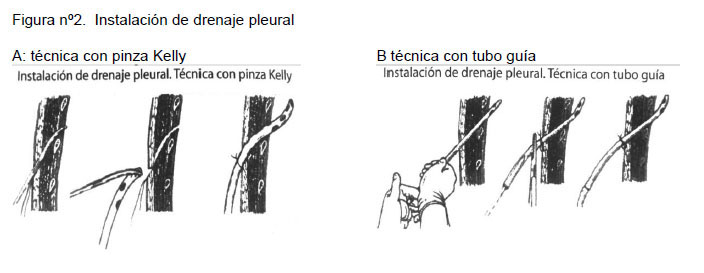
En cuanto al tamaño del tubo, en general se recomienda un tubo grueso y proporcional al tamaño del paciente de forma que no se obstruya con fibrina. En la actualidad disponemos de tubos de drenaje con guías metálicas o sin ellas, en ambos casos la instalación debe realizarse en forma cuidadosa para evitar complicaciones. El tubo de drenaje quedará instalado como se muestra en la figura 2 .Se sugiere revisar la técnica de instalación de drenaje pleural en capítulo 55 del libro “Cirugía Pediátrica” 2º Edición. Carmen Gloria Rostion A. Editorial Mediterraneo.
Una vez instalado el tubo debe conectarse a una botella con sello de agua de 1 a 2 cm. La botella debe mantenerse por debajo del nivel del pecho del paciente en todo momento. La botella debe tener un sistema que permita el escape de aire o respiradero o conectarse a un sistema de aspiración y en este caso se debe mantener una presión de aspiración de 5 a 10 cm de agua para evitar bloqueo del tubo.
En la figura nº 3 se muestra las distintas conexiones a botellas de agua, con sistema aspirativo y no aspirativo
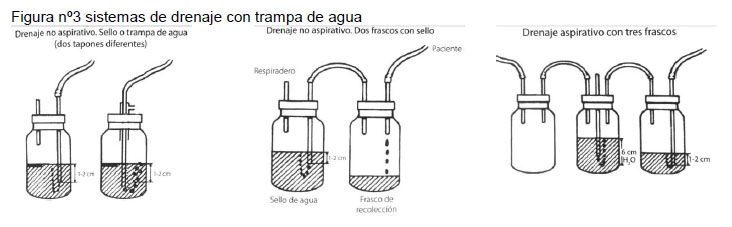
La oscilación respiratoria del líquido en el tubo refleja la permeabilidad del tubo y confirma su posición en la cavidad pleural, pero hay que considerar que la aspiración continua en ocasiones no permite ver la oscilación.
El drenaje se retira cuando ha cumplido su objetivo o ha dejado de funcionar. En general esto ocurre cuando drena <2ml por kg de peso por día.
3. Fibrinolíticos
Los fibrinolíticos pueden desintegrar la fibrina y despejar los poros linfáticos restableciendo la reabsorción del líquido pleural y han demostrado acortar la estadía hospitalaria en empiemas, al compararlo con el tratamiento con tubo pleural exclusivo. El problema es que esta terapia tiene un alto costo y no ha mostrado mejores resultados que el manejo quirúrgico. En niños el fibrinolítico más estudiado es la uroquinasa sin evidencia que demuestre que tenga mejores resultados que otros fibrinolíticos.
La uroquinasa se administra dos veces al día durante 3 días, utilizando 40.000 unidades en 40 ml de solución salina al 0,9% para niños de 1 año o más y 10.000 unidades en 10 ml de solución salina al 0,9% para niños menores de 1 año.
4. Manejo quirúrgico
Los procedimientos quirúrgicos que se utilizan en el tratamiento de las pleuroneumonías incluyen a:
a. VATS (videotoracoscopía)
b. Toracotomía mínima
c. Decorticación pleuropulmonar
La videotoracoscopía está indicada en la fase fibrinopurulenta del empiema pleural. Permite tomar muestras para cultivo, debridar los tabiques, retirar fibrina y recuperar una cavidad pleural única. Debe ser realizada en pabellón por cirujanos entrenados en la técnica. De no disponerse de los elementos o de la capacidad técnica se pueden lograr similares objetivos mediante una toracotomía mínima.
En los casos de consulta tardía o demora en la instalación del drenaje pleural, el pulmón puede quedar atrapado en una coraza de fibrina con una pleura visceral muy engrosada y vascularizada. En estos casos ya no es útil el aseo mediante videotoracoscopía y se debe realizar una decorticación pleuropulmonar. Para evitar llegar a esta etapa es fundamental el diagnóstico y tratamiento oportuno y drenar sin demora la cavidad pleural en pacientes con derrame paraneumónico.
V. SEGUIMIENTO
Los niños deben seguir con controles médicos después del alta, hasta que se hayan recuperado completamente y la radiografía de tórax haya vuelto a la normalidad.
Se debe solicitar una radiografía del tórax de control a las 4-6 semanas, plazo en el que debiera haber vuelto a la normalidad.
Referencias
- Brooks W, Goswami D, Rahman M, et al. Influenza is a major contributor to childhood pneumonia in a tropical developing country. Pediatr Infect Dis J 2010; 29(3): 216-221
- Psallidas I, Corcoran JP, Rahman NM. Empyema hospitalization increased in US children despirte pneumococal conjugate vaccine. Pediatrics 2010;125:26-33
- Ferrari A, Pirez G, Martínez A,et al Etiology of community acquired pneumonia in inpatients children. Uruguay 1998-2004 Rev Chil Infect 2007; 24 (1): 40-47
- Carter E, Waldhausen J, Zhang W, Hoffman L, Redding GJ. Management of children with empyema: pleural drainage is not always necessary. Pediatric Pulmonol 45(5):475-480, 2010.
- Proesmans M, Gijsens B, Van de Wijdeven P, et al. Clinical outcome of parapneumonic empyema in children treated according to a standardized medical treatment. Eur J Pediatr. 2014 Oct;173(10):1339-45.
- Psallidas I, Corcoran JP, Rahman NM, et al. Management of parapneumonic effusions and empyema. Semin Respir Crit Care Med. 2014 Dec;35(6):715-22.
- Cirugía Pediátrica. 2º Edición. Capítulo 55. Carmen G. Rostion A. Ed. Mediterraneo.
|

