Introducción
La estenosis hipertrófica del píloro (EHP), anteriormente conocida como hipertrofia congénita del píloro, fue descrita por primera vez en 1646, siendo posteriormente presentado por Harald Hirschsprung en 1888,
quien contribuyó en la caracterización clínica y patogénesis de la enfermedad. En ese entonces, el tratamiento de elección era médico debido a la alta mortalidad de la cirugía la que alcanzaba a un 100%. En 1912 Wilhelm Conrad Ramstedt modificó la forma de realizar la cirugía de manera exitosa, procedimiento que ha perdurado hasta el día de hoy casi sin variaciones3, desplazando el manejo médico en el tratamiento de la patología.
Etiopatogenia
En pacientes con EHP, la porción pilórica del estómago se encuentra anormalmente gruesa, resultando un engrosamiento y elongación del canal pilórico. Este fenómeno se produce después del nacimiento2, generando una obstrucción gástrica que produce una dilatación, hipertrofia e hiperperistalsis compensatoria del estómago.
A pesar de múltiples investigaciones sobre el tema, aún no se conoce con exactitud la causa de la EHP, probablemente siendo de etiología multifactorial, incluyendo factores ambientales y genéticos.
Sobre teorías propuestas, una línea propone una descoordinación entre el peristaltismo gástrico y la relajación pilórica, lo que implicaría una contracción gástrica contra un píloro ocluido, que llevaría a hipertrofia en el músculo pilórico Otra hipótesis propone que producto de una hipergastrinemia se produce un aumento en la producción de ácido gástrico, contracciones cíclicas periódicas en el píloro y vaciamiento gástrico lento. Por otra parte, hay estudios que señalan que al analizar muestras de las capas musculares de pacientes afectados de EHP presentan
una denervación anormal de las capas musculares o un desequilibrio entre las terminaciones nerviosas, asociado a una disminución de la producción de óxido nítrico2 (encargado de relajar el músculo liso) lo que lleva a una inadecuada relajación del píloro; a lo que se agrega el aumento en las concentraciones de factores de crecimiento, con la consecuente hipertrofia, hiperplasia y obstrucción. Estudios recientes han demostrado que el proto-oncogén C-KIT, esencial para el desarrollo o mantención de la motilidad autónoma intestinal, podría tener un importante rol en la patogénesis de la EHP8.
Entre los factores ambientales se encuentran: tabaquismo materno durante el embarazo, alimentación con fórmula en vez de lactancia materna exclusiva11, exposición a pesticidas agrícolas18.
Sobre el uso de macrólidos, se ha demostrado la asociación entre el uso de eritromicina y, recientemente de azitromicina, en el desarrollo de EHP. El riesgo de desarrollar EHP se relaciona inversamente con la edad de exposición del antibiótico, siendo mayor en las primeras 2 semanas de vida, disminuyendo progresivamente para ser inexistente en los mayores de 6 semanas17. El medicamento puede ser administrado directamente al lactante o en la madre a través de la leche materna al recién nacido². El mecanismo por el que se produce esta relación no está claro, se postula que se daría por el efecto procinético de la eritromicina en la contracción de la musculatura gástrica.
Entre los factores genéticos, se ha comprobado una significativa agregación familiar de la enfermedad, con un aumento de la incidencia hasta un 15% en pacientes con un antecedente de un familiar afectado y cuyo riesgo de enfermar es del 3,2% si un hermano ha sido afectado, del 4,2% si el padre tuvo la enfermedad, del 22% si un gemelo ha sido afectado y del 25,4% si la madre fue la afectada.
Epidemiología
La EHP tiene una incidencia de aproximadamente 0,1-0,2% en la población general8. Es más común en recién nacidos hombres que mujeres (4-6:1), en pacientes prematuros y primogénitos (30-40% de los casos), siendo menos frecuente en hijos de madres de mayor edad. Los síntomas se pueden iniciar desde los 2 meses de vida, siendo con mayor frecuencia entre las 3-5 semanas y rara vez después de las 12 semanas de vida1. La edad de presentación tiene que ver con la relación existente entre el aumento de volumen de alimentación enteral y la anomalía del segmento pilórico4.
Cuadro clínico
Se presenta clínicamente como un síndrome pilórico, producto de una obstrucción al flujo de salida del estómago2. La presentación clásica se caracteriza por un paciente previamente sano de sexo masculino, primogénito, de 2-6 semanas de vida con adecuado incremento pondoestatural que presenta de forma repentina vómitos postprandiales no biliosos. A pesar de estar enfermo, inicialmente el lactante se encuentra hambriento lo que se manifiesta como irritabilidad, inquietud y llanto intenso luego del vómito⁸. En un comienzo se puede confundir con un reflujo gastroesofágico fisiológico, pero luego evoluciona a vómitos explosivos hasta en el 70% de los casos12. Posteriormente, secundario al ayuno y los vómitos, se puede presentar deshidratación de grado variable que depende más de la intensidad del cuadro que de la duración de este.
Entre los signos tardíos se encuentran: hematemesis por gastritis secundaria o desgarro de la mucosa (Síndrome de Mallory Weiss), constipación por insuficiente ingesta de líquido y leche, deshidratación severa, baja ganancia de peso e ictericia que corrige al mejorar el cuadro.
Al examen físico se puede palpar la oliva pilórica que se busca de preferencia con el paciente tranquilo, luego del vómito o en ayuna, en posición decúbito supino, sobre una superficie lisa y firme con las rodillas flectadas. El médico se ubica a la izquierda del paciente, sentado frente a él y con su mano izquierda palpa suavemente en el epigastrio, se constata una masa ovoide, móvil, de 1-2cm de diámetro, en la línea media o en cuadrante superior derecho. La palpación de la oliva pilórica depende de la experiencia del explorador, va del 85-100% de los casos, cifra que disminuye en etapas iniciales y que va en descenso al pasar de los años, probablemente relacionado con el uso precoz de imágenes en el diagnóstico2. Si durante el examen físico se administran líquidos pueden verse ondas peristálticas de lucha desde el hipocondrio izquierdo hacia el epigastrio que no se observan hacia la derecha del ombligo⁸. Posterior a la ingesta, probablemente se desencadene el vómito de manera que el médico puede observar sus características.
Se deben buscar de forma dirigida signos de deshidratación tales como: fontanelas deprimidas, mucosas secas, llanto sin lágrimas, piel sin turgor y letargia.
Diagnóstico
El diagnóstico es clínico, en la que una historia clínica sugerente y la presencia de vómitos explosivos, peristaltismo gástrico visible y la oliva pilórica palpable (triada característica) confirman el diagnóstico en el 90% de los casos8. Situaciones en las que no se necesitarían mayores estudios imagenológicos.
Estudios complementarios
Cuando el diagnóstico no es claro a pesar de la historia y el examen físico, se deben obtener imágenes. El estudio de elección es la ultrasonografía abdominal.
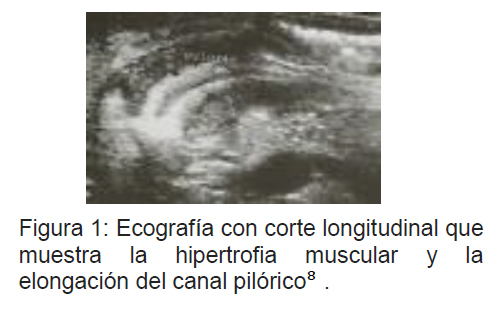
Ecografía abdominal: Tiene una sensibilidad de 90-99% y una especificidad del 97-100% en manos de un ecografista entrenado13. Clásicamente muestra una musculatura pilórica engrosada, con un área central hipoecogénica que corresponde al lumen. Hace el diagnostico un canal pilórico mayor a 14 mm de longitud y mayor a 4 mm de espesor3, con límites de normalidad en 12mm y 2mm respectivamente.
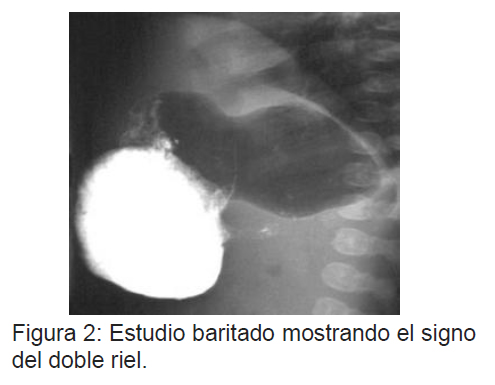
Estudio contrastado: Luego de la ingesta de bario, a través de radiología convencional, se puede observar una imagen filiforme y alargada del píloro. El paso del medio de contraste es lento o nulo y se observa un estómago distendido. Se describe el "signo del hombro" que corresponde una colección de bario en el antro pre pilórico dilatado y el " signo de la cuerda" o "doble riel", dos líneas delgadas de bario comprimidas entre mucosa pilórica engrosada, que se debe al paso filiforme del medio14.
Endoscopia digestiva alta: podría ayudar en el diagnóstico, pero no se recomienda de rutina a menos que el resto de los exámenes no sean decidores³.
Exámenes de laboratorio
Secundario a la hiperemesis hay una pérdida de ácido clorhídrico con lo que aumenta la concentración de bicarbonato, lo que lleva a retención de hidrogeniones por parte del riñón en desmedro del potasio8, por lo que clásicamente se encuentra una alcalosis metabólica hipoclorémica hipokalémica.
Otro hallazgo es la elevación de la bilirrubina indirecta que se puede explicar por disminución del tránsito gastrointestinal con aumento de la circulación enterohepática2.
Diagnóstico diferencial
- Reflujo gastroesofágico fisiológico: representa una condición más común que la EHP. Se caracteriza por regurgitación post alimentación, en general sin vómitos explosivos y en un lactante con buen estado general y adecuado incremento pondoestatural.
- Gastroenteritis viral.
- Obstrucción intestinal ya sea por un vólvulo intestinal, hernia atascada, causas congénitas u otras. Estas condiciones suelen presentar vómitos biliosos y un rápido deterioro clínico a diferencia de la EHP.
- Hiperplasia suprarrenal congénita la que se manifiesta entre otras cosas con vómitos y letargia, pero al laboratorio destaca acidosis metabólica, hipoglicemia e hiperkalemia.
- Infecciones respiratorias, tracto urinario o sistema nervioso central.
- Adenomioma gástrico.
Tratamiento
Tratamiento inicial
El tratamiento actual es la cirugía, la cual debe realizarse una vez corregidas las alteraciones hidroelectroliticas y acido base del paciente, por lo que ante la sospecha diagnóstica corresponde derivar al menor al servicio de urgencia respectivo para realizar exámenes de laboratorio e iniciar la corrección parenteral correspondiente. Según el grado de deshidratación del lactante, se puede iniciar una infusión de 20ml/kg de solución fisiológica para rehidratar. Una vez asegurada la diuresis se puede indicar una solución de glucosa al 5% y cloruro de sodio al 0,45% con cloruro de potasio (20-30mmol/L) a una velocidad de 150 ml/kg en 24 horas3.
La estabilización puede demorar unas 48-72h, por lo que se debe indicar régimen cero y colocar sonda nasogástrica para descomprimir el estómago. La meta es corregir los trastornos electrolíticos a rangos cercanos a la normalidad; potasio sérico de al menos de 3-4.5mEq/L, sodio sérico mayor a 130mEq/L, CO2 menor a 27-30mEq, el cloro suele corregir con las medidas previamente mencionadas.
Tratamiento quirúrgico
Una vez compensado el paciente, se lleva a cabo la resolución quirúrgica que consiste en la piloromiotomía de Fredet-Ramstedt. Esta técnica, implementada en 1912, consiste en la sección quirúrgica de la capa seromuscular del píloro, sin cortar la mucosa, en sentido del eje mayor de este, permitiendo así la protrusión de la mucosa con lo que normaliza el diámetro del canal pilórico. La operación generalmente se hace por laparotomía, aunque también se puede a través de técnica laparoscópica que ha demostrado ser segura y efectiva con menor tiempo operatorio y estadía hospitalaria15.
En el posoperatorio se inicia la alimentación habitual del niño. La tendencia actual es realimentar a las 6 h, una vez que el paciente se ha recuperado de la anestesia, con leche materna o fórmula sin diluir al volumen completa2. Pueden aparecer vómitos posoperatorios, que ceden entre la segunda y quinta toma. Una vez asegurada la vía oral, que generalmente ocurre en 24 h, se puede dar el alta al paciente.
Entre las complicaciones postoperatorias se describen apnea posoperatoria, hipoglicemia, obstrucción postoperatoria, perforación de la mucosa y fallecimiento que ocurre en menos del 1 % de los casos.
Tratamiento farmacológico
Como se mencionó anteriormente, el tratamiento de elección de la EHP es la piloromiotomia. Sin embargo, una opción es el tratamiento médico que consiste en la utilización de sulfato de atropina, cuyo mecanismo de acción es el bloqueo colinérgico que relaje las fibras musculares del píloro19. Un meta análisis reciente mostró que tanto el sulfato de atropina endovenoso como oral, presentan tasas de remisión de un 70% a un 85% respectivamente, con normalización del píloro entre 5 semanas a 15 meses, por lo que se considera una alternativa importante en caso de comorbilidades que contraindiquen la cirugía o ante la negativa de los padres20. Dentro de los inconvenientes del tratamiento médico se encuentra mayor estadía hospitalaria, tratamiento prolongado2 y efectos adversos que se presenta en caso de tratamiento endovenoso como la taquicardia o el enrojecimiento. Por otro lado, el riesgo anestésico y operatorio de la piloromiotomía son bajos, asociado a tasas de curación que alcanzan un 97-100%, hacen que no se justifique someter a este tipo de tratamiento prolongado al paciente⁸.
Pronóstico
Una vez operado, el paciente evoluciona favorablemente y los estudios no muestran diferencias significativas en cuanto al vaciamiento gástrico o reflujo duodenogástrico en pacientes operados versus controles1.
Conclusión
La EHP representa una patología común en el lactante menor. Es una enfermedad cuyas complicaciones se pueden evitar, por lo que un diagnóstico precoz mediante la historia clínica y el examen físico es fundamental. Como médico general, se debe derivar toda sospecha de EHP a un centro de mayor complejidad. Por el momento, el tratamiento de elección sigue siendo el abordaje quirúrgico aunque los resultados del manejo médico son aceptables y debe considerarse como terapia alternativa.
Referencias
- Peters B, Oomen Mw, Bakx R, Benninga MA (2014). Advances in infantile hypertrophic pyloric stenosis. Expert Rev Gastroenterol Hepatol. 2014. Jul; 8 (5): 533-41, doi: 10.1586/17474124.2014.903799, Epub 2014 Apr 10.
- Ronald Noguera (2009). Estenosis hipertrófica del píloro. Rev Cubana Pediatría ( 81 [3]). Recuperado de http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S003475312009000300008&Ing=es.
- Nigel J Hall, Agostino Pierro (2013). Pyloromyotomy. En: Lewis Spitz, Arnold Coran, editors. Operative Pediatric Surgery, seventh edition. Capítulo 45, pág 385-390. Editorial CRC Press.
- Judith D. Ranells, Jane D. Carver, Russel S. Kirby (2011). Infantile Hypertrophic Pyloric Stenosis: Epidemiology, genetics, and clinical update. Advances un Pediatric 58 ( 2011) 195-206.
- Hoehner JC (2004). Estenosis pilórica. En: Hoekelman RA, Adam HM, Nelson NM, Weitzman ML, Wilson MH, editores. Atención primaria en Pediatría. 4ta ed. Barcelona: Editorial Océano; 2004. p.1670-4
- Rogers IM. The true cause of pyloric stenosis is hyperacidity. Acta Paediatr 2006;95:132-6.
- Panteli C (2009). New insights into the pathogenesis of infantile pyloric stenosis. Pediatr Sur Int. 2009. Dec; 25 (12): 1043-52. Doi: 10.1007/s00383-009-2484-x.Epub 2009 Sep 16
- Ricardo Ibañez, Constanza Ibañez. En: Carmen Gloria Rostión. Cirugía Pediátrica (2012). Estenosis hipertrófica del píloro. Capítulo 66, pág 524-525. Editorial Mediterráneo.
- Christopher M Stark, Philip L. Rogers, Matthew D. Eberly, Cade M. Nylund (2015). Association of prematurity with the development of infantile hypertrophic pyloric stenosis. Pediatric research (2015) 78, 218-222 doi: 10. 1038/pr. 2015.92. Advance online publication 10 june 2015.
- Aboagye J. Goldstein SD, Salazar JH, et al (2014). Age at presentation of common pediatric surgical conditions: Reexamining dogma. J Pediatr Surg 2014; 49:995.
- Krogh C, Gørtz S, Wohlfahrt J, et al (2012). Pre- and perinatal risk factors for pyloric stenosis and their influence on the male predominance. Am J Epidemiol 2012; 176:24.
- Cincinnati Children`s Hospital Medical Center (2007). Evidence based clinical practice guideline for hypertrophic pyloric stenosis. Cincinnati Children`s Hospital Medical Center; 2007 Nov 14.
- Maheshwari P. Abograra A, Shamam O (2009). Sonographic evaluation of gastrointestinal obstruction in infants: a pictorial essay. J Pediatr Sur.2009 Oct. 44 (10);2037-42.
- Gloría del Pozo García (2009). En:SERAM. Radiología esencial, editores J.L.del Cura, S. Pedraza, A.Gayete. El tracto digestivo pediátrico y el peritoneo, cap: 122, pág 1650-1653. Ed. Médica Panamericana, 15-12-2010.
- Saha N, Saha DK, Rahman MA, Aziz MA, Islam MK. Laparoscopic versus open Pyloromyotomy for Infantile Hypertropic Pyloric Stenosis: An Early Experience. Mymensingh Med J.2012 Jul.2183):430-4.
- Hoehner JC. Estenosis pilórica. Rn: Hoekelman RA, Adam HM, Nelson NM, Weitzman ML, Wilson MH, editors. Atención primaria en Pediatría 4ªedición Barcelona: Editorial Oceáno; 2004.p.1670-4.
- Eberly MD, Eide MB, Thompson JL, Nylund CM. Azithromycin in Early Infancy and Pyloric Stenosis. 2015;135(3). doi:10.1542/peds.2014-2026.
- Markel TA, Proctor C, Ying J, Winchester PD. Environmental pesticides increase the risk of developing hypertrophic pyloric stenosis. J Pediatr Surg. 2015;50(8):1283-1288. doi:10.1016/j.jpedsurg.2014.12.009.
- Brown JH. Atropine, scopolamine and related anti-muscarinic drugs. In: Gilman AG, Rall TW, Nies AS, Taylor P, editors. Goodman and Gilman’s pharmacological bases
- Wu SF, et al., Efficacy of Medical Treatment for Infantile Hypertrophic Pyloric Stenosis: A Meta-analysis, Pediatrics and Neonatology (2016), http://dx.doi.org/10.1016/j.pedneo.2016.02.005
|

