La infección por virus de inmunodeficiencia humana (VIH) se ha transformado en una pandemia, especialmente en mujeres y niños, grupos en los que ha aumentado en forma alarmante la seroprevalencia. De los 37.8 millones individuos portadores de la infección (VIH) o la enfermedad (SIDA) estimados a diciembre del 2003, el continente africano concentra la mayor proporción de pacientes VIH/SIDA (25 millones). Pese a que el número de infectados y enfermos de América Latina parece significativamente inferior (1,6 millones), éste supera las cifras de Norteamérica, El Caribe y Europa occidental. La organización mundial de la salud (OMS) informó de 2.1 millones de niños con VIH/SIDA en diciembre del año 2003, con 630.000 infecciones nuevas cada año y 490.000 fallecimientos anuales en niños por esta causa (1).
Las complicaciones neurológicas en pacientes con SIDA fueron descritas en adultos en 1983 (2). Un año después se publicaron las primeras descripciones de encefalopatía asociada a SIDA en niños (3). En relación al compromiso neurológico en VIH/SIDA se estima que hasta el 90% de los individuos infectados tendrán algún compromiso del sistema nervioso central (SNC) (4), desde una infección subclínica, déficit cognitivo-motor sutil, o una demencia grave. En niños en una serie de 340 pacientes con sida adquirido por transmisión vertical se describe una incidencia de alteraciones neurológicas de 49%, siendo en muchos de los casos la forma de presentación de la enfermedad (5).
Historia natural del VIH/SIDA pediátrico
La gran mayoría de los niños con VIH son infectados por transmisión vertical. El riesgo de infección vertical es de alrededor de 25%, con un rango estimado de 13-43% según la región (6); este riesgo disminuye a 2% o menos si se toman las medidas adecuadas relacionadas a tratamiento antirretroviral oportuno y abstención de lactancia materna (7, 8). Cuando ocurre transmisión vertical, 26-38% sucede durante la gestación y 65-74% durante el parto (9). En cuanto a la lactancia, ésta aumenta el riesgo de infección de 14% a 16% (10). Estos datos hacen de gran relevancia la implementación de programas dirigidos al diagnóstico prenatal e intervenciones preventivas.
El diagnóstico de infección en un hijo de madre VIH depende de la edad. En lactantes menores de 18 meses, el cultivo de VIH es considerado el examen de elección (11), sin embargo, la reacción de polimerasa en cadena (PCR) se utiliza más frecuentemente por ser un método más accesible, más rápido y de sensibilidad similar al cultivo. La sensibilidad de PCR para VIH es 38% el primer día de vida, 93% el día 14, y 96% el día 28. Se requieren dos exámenes positivos para hacer diagnóstico con un 98.5% de certeza. A aquellos pacientes con 2 PCR negativas pero con antecedentes de infección materna se debe realizar análisis de ELISA a los 18 meses a modo de confirmación (7).
En niños mayores de 18 años el diagnóstico se realiza de igual manera que en adultos, mediante 2 análisis de ELISA positivos confirmados con estudio de Western Blot positivo para anticuerpo específico para VIH. Este examen tiene falsos positivos de 1:400.000 (12).
De acuerdo al estudio de Moroni et al (13), dejada a su curso natural la enfermedad puede tener dos tipos de evolución: un curso rápido que se observa en 20% de los niños en el cual las manifestaciones clínicas e inmunológicas del SIDA se presentan antes del año de vida (curso rápido), con fallecimiento a causa de las complicaciones asociadas entre el primer y cuarto año de vida. Un segundo grupo de niños tiene un curso más lento, con supervivencia de 75% al quinto año de vida, y una sobrevida promedio total de 9 -10 años.
Con el uso precoz de terapia antirretroviral se ha observado un aumento en las expectativas de vida y una disminución de las complicaciones conocidas, entre las cuales las neurológicas, específicamente la encefalopatía, muestra una disminución de incidencia de 16-30% a un 4%.
Neuropatología
La infección por VIH en adultos se produce en un cerebro completamente desarrollado, a diferencia de la infección por transmisión vertical que afecta a un sistema nervioso que está en pleno desarrollo. Esto explicaría los diferentes efectos del VIH en niños en comparación a los adultos (13).
Un aspecto relevante es el estado inmunológico del paciente. Así, se han observado diferencias en el compromiso neurológico entre los niños que adquieren el virus en forma vertical y aquellos que se infectan posteriormente cuando y tienen un sistema inmunológico completamente desarrollado.
La vía por la cual el virus accede al SNC no está totalmente definida. Se ha sugerido que el virus ingresa a través de monocitos y macrófagos de sangre periférica, hipótesis que es apoyada por el hallazgo frecuente de calcificaciones de los ganglios de la base (14). Otra posibilidad es la invasión directa como virus libre a través del plexo coroidal o a través de las células endoteliales.
Mecanismos neuropatológicos
Los mecanismos a través de los cuales la infección por VIH produce daño en el sistema nervioso no están completamente aclarados. Estudios realizados en cerebros de niños fallecidos por infección HIV demuestran que el virus infecta principalmente macrófagos y microglía, ubicados en ganglios basales, núcleo subatalámico, sustancia nigra, núcleo dentado y sustancia blanca (15). Estas células expresan receptores CD4+ y B citoquinas (CCR5 y CXCR4) que permiten que el virus ingrese a ellas (13).El principal hallazgo neuropatológico asociado a la encefalitis VIH corresponde a la formación de células gigantes multinucleadas que serían producto de la fusión de macrófagos y microglía infectadas y no infectadas. Los astrocitos incorporan el virus a través de receptores CCR5 y CXCR4; actúan como reservorio viral, diseminando el virus a macrófagos y micloglía (16).
La exposición de neuronas al líquido extracelular de macrófagos y astrocitos infectados que contienen altas concentraciones de proteínas virales, citoquinas y productos celulares tóxicos, producen excesiva activación de receptores de glutamato, particularmente los receptores N-metil-D-aspartato (NMDA) con un incremento del flujo de calcio a la célula y muerte neuronal (17).
Se han identificado tres factores virales responsables de estos procesos:
- La glicoproteína de la envoltura viral, o Gp120, que promueve el estrés oxidativo e induce apoptosis neuronal.
- La proteína reguladora no estructural del virus VIH, Tat, neurotóxica en cultivos de neuronas fetales humanas mediante activación de receptores de glutamato (kainato) y productora de estrés oxidativo por disminución de la actividad de la enzima manganeso superóxido dismutasa.
- El factor de necrosis tumoral alfa y ácido araquidónico.Los macrófagos infectados con VIH y activados por astrocitos producen citoquinas altamente neurotóxicas como son el factor de necrosis tumoral α, IL 1β, IL1α, IL6, factor activador plaquetario, leucotrienos (LTB4, LTD4), lipoxina A y ácido araquidónico, que según diversos estudios alcanzan mayores concentraciones en cerebro y LCR de los pacientes con encefalopatía (18).
Estudios in vitro en neuroblastomas han demostrado que existiría daño neuronal por acción directa del virus, mediado por proteínas de la cubierta viral como mecanismo independiente de la intervención de macrófagos o microglía (19).
Cuadro Clínico
Las manifestaciones neurológicas en niños infectados por VIH pueden dividirse en cuatro grandes grupos.
- Enfermedad neurológica primaria: asociada a la acción directa o indirecta del retrovirus en el SNC.
- Complicaciones secundarias a inmunodepresión (infecciones, neoplasias, enfermedad cerebrovascular)
- Complicaciones sistémicas del VIH: causas metabólicas, endocrinológicas, otras.
- Complicaciones tóxico/metabólicas de la terapia antirretroviral.
Compromiso neurológico primario
El compromiso neurológico primario es un síndrome clínico complejo que se manifiesta por grados variables de retraso cognitivo, motor y alteraciones del comportamiento.
La complicación neurológica más frecuente en niños es la encefalopatía. La incidencia de ésta en una serie de 766 niños con infección vertical fue de 23%, con una edad promedio al diagnóstico de 19 meses y una sobrevida promedio de 22 meses (21). En una serie menor de 127 niños infectados la prevalencia de encefalopatía fue de 21% con una edad promedio de diagnóstico de 14 meses (14).
Según su perfil evolutivo el compromiso encefalopático puede ser progresivo o estático. La encefalopatía progresiva de acuerdo a la velocidad de progresión y gravedad de compromiso del desarrollo de SNC puede ser subdividida en encefalopatía subaguda y encefalopatía lentamente progresiva. (14).
Encefalopatía progresiva asociada a VIH
La encefalopatía progresiva (EP) asociada a VIH con evolución subaguda es la forma más grave. Se manifiesta por un síndrome piramidal bilateral, tetraparesia, microcefalia adquirida y pérdida de hitos del desarrollo psicomotor. Posteriormente se hace más evidente el deterioro cognitivo, con mayor compromiso de lenguaje expresivo que comprensivo, y compromiso de las conductas adaptativas. También pueden observarse alteraciones del movimiento, como rigidez, posturas distónicas, temblor (21).
En la forma en meseta, o lentamente progresiva, el deterioro del desarrollo psicomotor es más lento, manifestándose por una muy lenta adquisición de habilidades. Algunos niños después de un periodo variable de EP en meseta, presentan cierta mejoría funcional, semejando una encefalopatía estática (EE), fenómeno que se ha relacionado con la implementación de mejores programas antirretrovirales.
Encefalopatía estática
En esta forma la adquisición del lenguaje y del desarrollo psicomotor en general ocurren a un ritmo más lento, sin observarse pérdida de hitos (14).
El compromiso encefalopático se ha relacionado con una mayor carga viral y mayor grado de inmunosupresión, con la consiguiente mayor morbilidad asociada, hospitalizaciones por año (21) y menor sobrevida que los niños sin encefalopatía (22).
Los niños infectados por el virus requieren evaluaciones neuropsicológicas periódicas, ya que éstas han mostrado una buena correlación con el grado de encefalopatía y progresión de la enfermedad. En 722 niños sin tratamiento antirretroviral se realizó una evaluación cognitiva al inicio del estudio y una segunda 48 meses más tarde. Se observó que 56% de los pacientes con coeficiente intelectual (CI) menor a 70 presentaban progresión del compromiso neurológico, en tanto que en los niños con CI 70-89 el deterioro se observaba sólo en 26% de ellos y en los que tenían CI superior a 90 sólo en 18%. Las alteraciones descritas incluyen disminución de habilidades manuales y cognitivas, velocidad de procesamiento de información, atención, lenguaje y memoria verbal (23).
Complicaciones secundarias
-Infecciones oportunistas. Un segundo grupo de manifestaciones neurológicas corresponden a las complicaciones secundarias, dentro de las cuales se encuentran las infecciones oportunistas que ocurren principalmente en pacientes con mayor inmunosupresión, con una prevalencia menor a la observada en adultos (17). Los microorganismos involucrados incluyen hongos: meningitis y abscesos por Cándida albicans; parásitos: Toxoplasma gondii; bacterias: Mycobacterium tuberculoso, Treponema pallidum, Bartonella, Nocardia; y entre los virus destacan los virus herpes simple, herpes zoster, citomegalovirus y JC (siglas, en relación al nombre de primer paciente en que fue aislado).
El virus JC de la familia de los poliomavirus se ha identificado como agente etiológico de la leucoencefalopatía multifocal progresiva, cuadro desmielinizante del SNC, que afecta hemisferios cerebrales y cerebelo. La clínica depende de la localización de los focos de desmielinización, siendo la presentación típica un compromiso cognitivo progresivo y alteraciones visuales en el contexto de un paciente con inmunodepresión grave.
-Enfermedad Cerebrovascular (ECV). Los niños VIH positivos tienen una mayor prevalencia de ECV que aquellos niños no infectados. Los mecanismos fisiopatológicos involucrados incluyen un efecto directo del virus en las paredes de vasos sanguíneos, embolías cardiogénicas, trombocitopenia y vasculitis post infecciosa (24, 25).
En un estudio que reunió a 426 pacientes VIH positivos con edad promedio de 5 años, se evaluaron, a través de resonancia nuclear magnética, lesiones compatibles con enfermedad cerebrovascular, las que fueron encontradas en 2.6% de ellos, la mayoría sin correlato clínico (23). Sin embargo, estudios en autopsias de casos pediátricos han informado de cifras de hasta 25% (26).
-Neoplasias. El tumor maligno más común en niños y adultos VIH positivos es el linfoma no Hodgkin, primario o secundario, del SNC. Debe sospecharse frente a la presencia de déficit neurológico focal, convulsiones y alteraciones del estado de conciencia (27).
-Anormalidades del Sistema Nervioso Periférico. Son infrecuentes en niños. La alteración más frecuente es la polineuropatía axonal distal simétrica, en pacientes con una disminución del recuento de CD4. Los mecanismos fisiopatológicos implicados incluyen la participación de TNF-α, IL-1, IL-6 producidos por macrófagos infectados que infiltran nervios periféricos y ganglios dorsales. Hasta el momento no hay datos de incidencia de la polineuropatía en la era de la terapia antirretroviral, reconociéndose la asociación entre estas drogas y la neuropatía periférica, por lo que es improbable que ésta disminuya en los próximos años (28).
-Los trastornos psiquiátricos encontrados con mayor frecuencia son depresión en un 47% y trastornos de la atención en 29% (29).
El curso crónico de la enfermedad, hospitalizaciones frecuentes, enfermedad o fallecimiento de familiares, estigmas sociales de la infección por VIH y la coexistencia de alteraciones endocrinológicas y metabólicas, son algunas de las situaciones implicadas en el desarrollo de un cuadro depresivos. Los síntomas observados habitualmente son labilidad emocional, cambios de humor, agitación e impulsividad. En relación al avance de la enfermedad, se han publicado casos de psicosis aguda, confusión, agitación, delirio y manía (28).
Existen alteraciones que muchas veces son inadvertidas por los pacientes, entre ellas se encuentra: la disminución de las habilidades motoras finas y gruesas, hipotonía de extremidades y disminución del coeficiente intelectual, el que puede variar desde CI normal limítrofe a retardo mental severo (30).
Estudios de laboratorio (electroencefalogra-ma, potenciales evocados, líquido cefalorraquídeo) de pacientes VIH con retraso del desarrollo psicomotor y disfunciones neurológicas son habitualmente no específicos o normales (31).
En cuanto a las neuroimágenes, éstas tienen un importante rol en el estudio de SNC. Los hallazgos más frecuentemente encontrados en resonancia nuclear magnética o tomografía axial computada son atrofia cerebral en un 45%, calcificaciones de ganglios basales 9% y alteraciones de sustancia blanca 9% (32).
En resonancia magnética cerebral con espectroscopía, hay un significativo aumento de mioinositol y colina, con una disminución de N-Acetil aspartato de la sustancia blanca y los ganglios basales, lo que traduce injuria o muerte neuronal. En la sustancia gris no se observan diferencias significativas (33). Los hallazgos descritos son de especial relevancia dado que preceden a las manifestaciones clínicas de encefalopatía o de alteraciones estructurales en otro tipo de neuroimágenes.
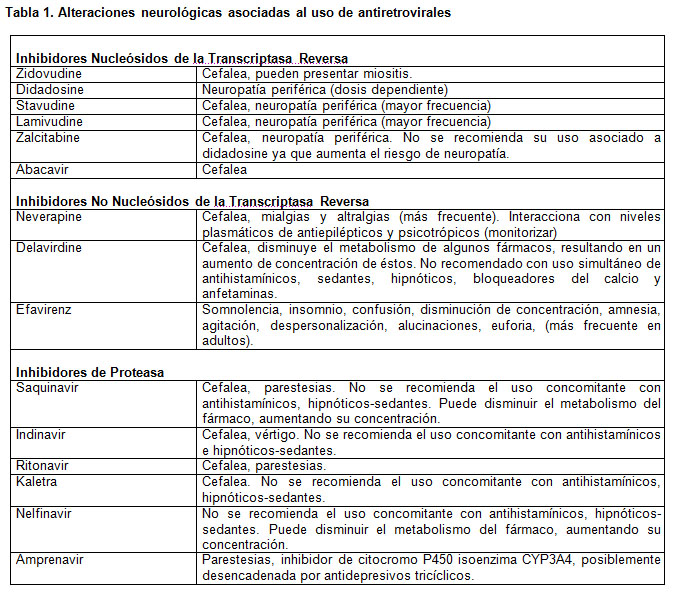
Tratamiento
El tratamiento de los pacientes infección VIH/SIDA exige la participación de un equipo multidisciplinario.
La intervención que hasta ahora ha demostrado mejores resultados terapéuticos, es el uso de fármacos antiretrovirales, los cuales intervienen en el control de la replicación viral. Se clasifican en inhibidores de la transcriptasa reversa, no inhibidores de la trascriptasa reversa e inhibidores de la proteasa.
En el tratamiento de complicaciones neurológicas se prefiere el uso de inhibidores nucleósidos de la transcriptasa reversa, específicamente zidovudina y abacavir, ya que tienen la propiedad de cruzar la barrera hematoencefálica, debido a su bajo peso molecular e hidrosolubilidad. Estos fármacos disminuyen la carga viral en plasma y líquido cefalorraquídeo.
El inicio precoz de terapia retroviral disminuye la incidencia de encefalopatía en niños HIV positivo y mejora la sobrevida en aquellos que ya la presentan.
En un estudio retrospectivo (34) de 189 niños con infección vertical se demostró que 14% de los niños con diagnóstico de encefalopatía que iniciaron tratamiento con zidovudina experimentaron mejoría en examen neurológico, el cual aumentó a 19% con el uso de más de un antiretroviral. Otros reportes describen que el uso continuo de zidovudina endovenosa por 6 meses en niños con encefalopatía mejoraría el CI en 15 puntos (35). También se ha descrito mejoría desde el punto de vista neurorradiológico, que constata disminución de la atrofia cerebral, tras 6 meses de tratamiento intensivo (36).
En relación al desarrollo de nuevas alternativas terapéuticas, destacan aquellos orientados al uso de mediadores inflamatorios del daño cerebral, bloqueadores de canales de calcio, antagonistas de receptores NMDA e inhibidores de citoquinas (18), mecanismos que van principalmente orientados a la prevención del daño tisular. Requieren mayores investigaciones para su implementación masiva.
Prevención
Se estima que 50% de los pacientes que adquieren el virus se encuentran entre los 13 y 24 años (37), por lo tanto éste es el grupo en el cual es necesario implementar medidas preventivas oportunas. Los pediatras junto con los padres tienen un importante rol en la guía anticipatoria, referente a la edad de inicio de relaciones sexuales, enfermedades de transmisión sexual, incluyendo el VIH y el síndrome de inmunodeficiencia adquirida. Se ha demostrado que educar a adolescentes sobre relaciones sexuales no aumenta la actividad sexual (38).
Otro grupo de fármacos son los dirigidos a tratar los desórdenes neurológicos asociados a la infección de VIH/SIDA (Tabla 2).
En cuanto al uso de drogas, se debe informar sobre el riesgo de infección a través de drogas inyectables. Debe enfatizarse además el riesgo que conlleva el uso de otras drogas, como alcohol, marihuana y cocaína, con la infección VIH, dado la mayor exposición a relaciones sexuales poco seguras (39).
Referencias
- Organización Mundial de la Salud (OMS) informe anual, junio 2004.
- Snide W., Nielsen D., Simpson D. Neurological complications of AIDS: analysis of 50 patients. Ann Neurol 1983; 14:.403-418.
- Belman A., Ultmann M., Horoupian D., Novick B., Spiro A., Rubinstein A., Kurtzberg D., Cone-wesson B. Neurological complications in infants and children with acquired immune deficiency syndrome. Ann Neurol.1985 Nov; 18(5): 560-6.
- Chiang F., Walot I., Sinow R., Mehringer C. (1998). Diagnostic imaging of the brain in acquired immunodeficiency syndrome (AIDS). Semin Ultrasound CT MR 19(2): 133-53.
- Rotta N., Silva C., Ohlweiler L. Manifestaciones neurológicas del sida en la infancia. Rev Neurol 1999; 29: 319-22.
- The working group on mother to child HIV. Transmission of, rates of mother to child transmission of HIV-1 in Africa, America, and Europe. Results from 13 perinatal studies. J Acquir Inmune defic Syndr 1995; 8: 506-510.
- Havens P., Waters D. Management of the infant born to a mother with HIV infection. Pediatr Clin North Am. 2004 Aug; 51(4): 909-37 Review.
- Benavides I. Recomendaciones para el manejo del recién nacido hijo de madre VDRL (+) y del recién nacido de madre VIH (+) Rev. Ped. Elec. [en línea] 2004, Vol 1, N° 1. ISSN 0718-0918. [Citado 21 abril 2005]
Disponible en Internet: http://www.med.uchile.cl/revistas/pediatria_norte/vol1num1/8.htm
- Dunn D., Brandt C. The sensitivity of HIV-1 DNA polymerase chain reaction in the neonatal period and the relative contributions of intrauterine and intrapartum transmission. AIDS 1995; 9: 7-11.
- Nduati R., Mbori-Ngacha D. Effect of breastfeeding and formula feeding on transmission of HIV-1: a randomized clinical trial. JAMA 2000; 283:1167-1774.
- Burgard M., Mayaux M., Blanche S. The use of viral culture and p24 antigen testing to diagnose human immunodeficiency virus infection in neonates. N Engl J Med 1992; 327:1192-1197.
- Powderly W., Mayer K. Centers for Disease Control and Prevention revised guidelines for human immunodeficiency virus (HIV) counseling, testing, and referral: targeting HIV specialists. Clin Infect Dis. 2003 Sep 15; 37(6): 813-9
- Moroni M., Antinori S. HIV and direct damage of organs: disease spectrum before and during the highly active antiretroviral therapy era. AIDS 2003, 17(supl 1): S51-S64.
- Tellechea N., O da silva C. Neurosida. Rev Neurol 1997; 25: 903-905.
- Sharer L. Pathology of HIV-1 infection of the central nervous system. J Neuropathol Exp Neurol 1992; 51: 3-11.
- Martín-Garcia J., Kolson D. Chemokine receptor in the brain: their role in HIV infection and pathogenesis. AIDS 2002, 16: 1709-1730.
- Epstein L., Geldelman H. Human immunodeficiency virus type 1 infection of de nervous system: pathogenic mechanisms. Ann Neurol 1993, 33: 429-436.
- Gelbard H., Epstein L. HIV encephalopathy in children. Curr Opin Pediatr. 1995 Dec; 7(6): 655-62.
- Alvarez S., Canto C., Muñoz-Fernandez M. A new possible mechanism of human immunodeficiency virus type 1 infection of neural cells Neurobiol Dis. 2002 Dec; 11(3): 469-78.
- Hesselgesser I., Taub D., Baskar P. Neuronal apoptosis induced by HIV gp120 and the chemokine SDF-1a is mediated by the chemokine receptor CXCR4. Curr Biol 1998; 8: 595-598.
- Lobato M., Caldwell M., Oxtoby M. Encephalopathy in children with perinatally acquired human inmunodeficiency virus infection. J Pediatr. 1995; 126(5): 710-16.
- Cooper E., Hanson C., Díaz C., Méndez H., Abboud R., Nugent R., Pitt J. Rich K. Rodriguez E., Smeriglio V. Encephalopathy and progression of human immunodeficiency virus disease in a cohort of children with perinatally acquired human immunodeficiency virus infection. Women and Infants Transmission Study Group. J Pediatr. 1998 May; 32(5): 808-12.
- Pearson D., McGrath N., Nozyce M., Nichols S. Raskino C., Brouwers P., Lifschitz M., Baker C., Englund J. Predicting HIV disease progression in children using measures of neuropsychological and neurological functioning. Pediatric AIDS clinical trials 152 study team. Pediatrics. 2000 Dec; 106(6): E76.
- Athos D., Wod L., Atac G. Cerebrovascular disease in HIV infected pediatric patients: Neuroimaging findings. American Journal Radiology 2002; 179: 999-1003.
- Kluger S., Barzilai A., Hodes D. Acute Hemiplegia associated with HIV infection. Pediatr Neurol. 1991; 7(3): 207-10.
- Greenberg S. Human retrovirus and demyelininating diseases. Neurol Clin 1995; 13: 75-79.
- Rotta N., Silva C., Ohlweiler L. Manifestaciones neurológicas del sida en la infancia. Rev Neurol 1999; 29: 319-22.
- Moroni M., Antinori S. HIV and direct damage of organs: disease spectrum before and during the highly active antiretroviral therapy era. AIDS 2003, 17(supl 1): S51-S64
- Misdrahi D., Vila G., Funk-Brentano I., Tardieu M., Blanche S., Mouren-Simeoni M. DSM-IV mental disorders and neurological complications in children and adolescents with human immunodeficiency virus type 1 infection (HIV-1.Eur Psychiatry. 2004 May; 19(3): 182-4
- Boiven M., Green S., Davies A., Giordani B. A preliminary evaluation of the cognitive and motor effects of pediatrics HIV infection in zarian children. Health Psychol. 1995; 14: 13-21.
- Yitzchak F., Vishnubhakat M. Brainstem auditory evoked responses in infants and children with AIDS. Pediatric Neurol 1992; 8: 262-266.
- Johann-Linang R., Lin K, Cervia J. Neuroimaging finding in children perinatally infected with the human immunodeficiency virus. Pediatr Infect Dis J. 1998 Aug;17(8): 753-4.
- Gonzalez R. Imaging Neuro AIDS. AJNR 2004; 25(2): 167-8.
- Sanchez-Ramon S., Resino S., Bellon Cano J.M., Ramos J.T., Gurbindo D., Munoz-Fernández A. Neuroprotective effects of early antiretrovirals in vertical HIV infection. Pediatr Neurol. 2003 Sep; 29(3): 218-21.
- Brouwers P., Moss H. Effect of continuous infusion zidovudine therapy on neuropsychologic funtoning in children with SIDA. J Pediatrics 1990; 117: 980-985.
- Decarli C., Fugate L. Brain growth and cognitive improvement in children with HIV. J Acquir Immune Defic Syndr. 1991; 4(6): 585-92.
- Futterman D., Chabon B., Hoffman N.D. HIV and AIDS in adolescents. Pediatr Clin North Am 2000; 47: 171-188.
- Kirby D., Short L., Collins J. et al. School-based programs to reduce sexual risk behaviors: a review of effectiveness. Public Health Rep. 1994; 109: 339–360.
- American Academy of Pediatrics. Committee on Public Education, American Academy of Child and Adolescent psychiatry, American Psychological Association. Sexuality, contraception, and the media. Committee on Public Education. Pediatrics. 2001 Jan; 107(1): 191-4.
|

